21. La digital pathology, una risorsa al servizio dei pazienti
a cura di F. Fraggetta, V. L’Imperio e A. Sapino – SIAPeC
La rivoluzione tecnologica che negli ultimi anni ha colpito diversi ambiti della vita quotidiana non ha risparmiato il settore sanitario, modificando progressivamente il mondo della medicina a diversi livelli, apportando significativi miglioramenti e proponendo nuove sfide per i professionisti del settore. Nel campo dell’anatomia patologica, l’avvento dei nuovi strumenti di digitalizzazione e telecomunicazione ha permesso di trasformare i preparati cito-istologici, c.d. “vetrini”, tradizionalmente visti al microscopio, in immagini “digitali”, visibili sullo schermo di un computer. Questo processo di scannerizzazione delle immagini ne permette la condivisione anche a distanza, la “navigazione” del vetrino. Queste immagini digitali rappresentano ad oggi delle vere e proprie copie fedeli del vetrino cito-istologico con possibilità di utilizzare diversi ingrandimenti e multipli piani di fuoco per la loro corretta visualizzazione (virtual microscopy), come se si lavorasse con il vetrino ed il microscopio “convenzionali”. Per rendere più chiaro quanto sia fattibile, si pensi a ciò che accade per le fotografie digitali dove si possono ingrandire campi di interesse sul telefono cellulare e questo può essere fatto anche per un preparato cito-istologico digitalizzato.
Questa innovazione ha dato vita alla “patologia digitale” o “digital pathology”, ampia area applicativa che spazia dalla telepatologia (trasmissione delle immagini a distanza), al miglioramento dei sistemi di gestione e archiviazione del materiale diagnostico nei laboratori (work-flow) per arrivare fino all’analisi informatica dei preparati al fine di identificare alterazioni non visibili ad occhio umano (artificial intelligence, AI)1. Uno dei primi esempi dell’efficacia della telepatologia in Italia è probabilmente rappresentato dall’istituzione nel 2001 dell’associazione “Patologi Oltre Frontiera”, basata sull’iniziativa di un gruppo di patologi italiani con lo scopo di istruire a distanza medici operanti in aree geografiche in via di sviluppo, e di fornire un supporto diagnostico remoto grazie alle infrastrutture di telecomunicazione disponibili[2].
“Ma come può questa rivoluzione digitale rappresentare una risorsa per il paziente?”
Le diverse branche della digital pathology hanno dimostrato negli ultimi anni dei significativi vantaggi sia per l’ottimizzazione dell’attività di reparto sia in termini di resa diagnostica (e prognostico/predittiva) per i pazienti, con particolare riferimento a quelli con problematiche oncologiche. Di seguito vengono discussi i possibili campi applicativi di queste nuove tecnologie con particolare enfasi sul loro possibile impatto nella cura del paziente oncologico.
Telepatologia e virtual microscopy: dal microscopio al monitor del computer
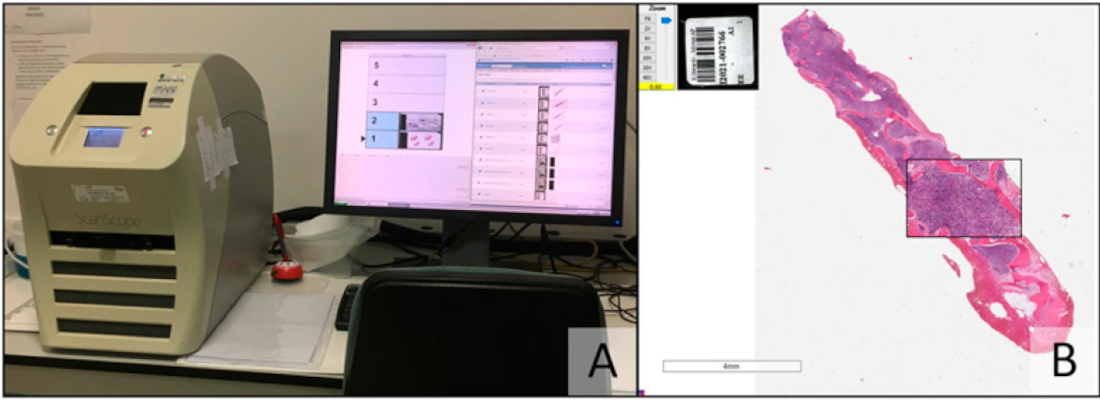
L’introduzione di scanner digitali capaci di trasformare il vetrino cito/istologico “fisico” in file digitali comodamente consultabili da computer ha posto le basi per la massiva diffusione della telepatologia e della virtual microscopy (Figura 1).
Figura 1: In A una postazione per la scansione di vetrini fisici per la loro trasformazione in file digitali consultabili da computer. In B il risultato della scansione con riproduzione di un vetrino digitalizzato che permette di ingrandire i dettagli fino a 40 volte, permettendo una valutazione ad alta risoluzione del preparato cito/istologico.
La versatilità di queste innovative metodiche di digital pathology è già stata ampiamente dimostrata in diversi campi, tra i quali3:
- interpretazione a distanza per la diagnosi primaria (telediagnosi)
- richiesta di parere, seconde opinioni o consultazioni (teleconsulto)
- ricerca ed educazione (uso accademico)
- valutazione dei preparati in sede di discussione multidisciplinare (gruppi multidisciplinari)
- revisione cito/istologica per arruolamento nei trial clinici (uso sperimentazione clinica)
L’implementazione di queste metodiche innovative è stata ulteriormente facilitata dalla loro approvazione nella routine clinica da parte delle principali agenzie regolatorie4 e dall’elaborazione di linee guida rigorose che aiutano nel coordinamento delle attività legate alla digital pathology da parte delle società di categoria5.
Specialmente in ambito oncologico, la crescente conoscenza delle basi biologiche e molecolari dei diversi tipi di neoplasia ha comportato l’ultra-specializzazione dei principali attori implicati nel processo diagnostico-terapeutico (es. oncologo e patologo), con la formazione dei c.d. Tumor Board (TB). Inoltre, lo sviluppo di centri di riferimento per le diverse patologie oncologiche ha determinato la creazione di reti integrate spoke-hub che permettono di garantire il miglior percorso di cura ritagliato sui bisogni del paziente e della sua malattia, secondo i più recenti concetti di tailored therapy e medicina di precisione.
In questo contesto, la possibilità di condividere in tempo reale, con la massima sicurezza e con affidabilità diagnostica i preparati cito/istologici con esperti, anche a distanza, rappresenta un’arma aggiuntiva per garantire il massimo standard di cura per il paziente. Inoltre, l’introduzione di nuovi approcci terapeutici ha ulteriormente enfatizzato il ruolo dell’anatomia patologica, oltre che nel processo diagnostico anche nella valutazione prognostico/predittiva, come emblematicamente testimoniato dall’introduzione dell’immunoterapia in diversi tipi di neoplasia6. Proprio nel campo dell’immunoterapia il continuo confronto da remoto tra patologi ha permesso di standardizzare l’interpretazione dei biomarcatori necessari per valutare l’eventuale beneficio nell’utilizzo di questi farmaci, raggiungendo un consenso su quali siano le migliori procedure e i migliori cut-off da utilizzare a tale scopo7.
L’utilizzo di questa metodica non si limita alla diagnosi definitiva sul campione biologico prelevato dal paziente, ma ha dimostrato anche ottimi risultati nella cosiddetta “diagnosi intraoperatoria”. Durante un intervento chirurgico, infatti, è possibile valutare una serie di parametri, come la radicalità dell’escissione tumorale e la negatività dei margini di resezione, mediante l’esecuzione di un piccolo prelievo di tessuto che viene congelato e poi analizzato tempestivamente dal patologo in pochi minuti. In quest’ambito la digital pathology permette di eseguire tale valutazione in tempo reale anche a distanza, soprattutto per i centri spoke che si appoggiano ad anatomie patologiche distaccate sul territorio8.
Tali vantaggi hanno portato alla completa traslazione di interi laboratori di anatomia patologica in digitale, come avvenuto dal 2006 nel centro svedese della Linköping University Hospital che ha radicalmente modificato la routine diagnostica del proprio laboratorio affidandosi alla digital pathology dalla ricezione del campione alla diagnosi finale9. Questo permette ai patologi l’accesso ai preparati cito/istologici anche dal normale computer di casa, esigenza divenuta particolarmente cogente durante il difficile periodo della pandemia da COVID-19 che stiamo vivendo. Infatti, l’implementazione della patologia digitale ha già ampiamente dimostrato nell’ultimo anno la capacità di garantire continuità diagnostica e assistenziale10, spingendo le più importanti autorità della salute (es. Food and Drug Administration – FDA) a proporre delle task force per la promozione e intensificazione dell’utilizzo di digital pathology11.
Anche il mondo dell’educazione in campo medico è stato travolto dalle esigenze imposte dalla pandemia con una progressiva transizione verso una forma di didattica a distanza anche nelle scuole di medicina. La digital pathology aveva già dimostrato un ruolo complementare alle metodiche più “classiche” nella formazione degli aspiranti giovani patologi12. In questo ultimo anno, però, l’applicazione degli strumenti di telepatologia durante le lezioni online ha ulteriormente evidenziato il loro impatto nel coinvolgimento degli studenti e degli specializzandi, fornendo un’anteprima fedele dell’attività di routine di un laboratorio di anatomia patologica13.
In ambito di ricerca e dei trial clinici, l’impiego della digital pathology ha determinato negli anni un miglioramento nell’accuratezza, riproducibilità e standardizzazione dei criteri di arruolamento e degli endpoint degli studi, promuovendo la creazione di lavori multicentrici grazie alla possibilità di condividere in tempo reale i preparati cito/istologici dei pazienti da includere tramite la formazione di Central Review Boards (CRB)14. Inoltre, l’applicazione di metodiche informatiche di image analysis e artificial intelligence hanno permesso di individuare caratteristiche utili alla valutazione diagnostica, prognostica e predittiva non altrimenti evidenziabili ad occhio nudo in diversi ambiti della patologia oncologica.
Digital pathology per ottimizzare le procedure di laboratorio in anatomia patologica
Tuttavia, per massimizzare i vantaggi della telepatologia è necessaria una rigorosa standardizzazione della cosiddetta fase “pre-analitica”, dall’arrivo del campione in laboratorio di anatomia patologica alla sua effettiva digitalizzazione e diffusione. Ecco che la digital pathology viene in soccorso anche in questo senso, tramite l’implementazione di sistemi di gestione informatizzata di laboratorio (LIS) che consentono di mantenere la tracciabilità in ogni fase della gestione del materiale biologico.
Il complesso processo di preparazione del vetrino cito/istologico prevede una serie di passaggi mediati da differenti operatori (amministrativi, tecnici di laboratorio e medici), con necessità di garantire la “tracciabilità” del percorso del campione e degli operatori responsabili dei singoli processi dal momento dell’arrivo in laboratorio fino alla diagnosi finale15, mediante ad esempio l’utilizzo di codici a barre univoci per campione e paziente gestiti dal LIS16,17,18.
Analisi informatica del preparato cito/istologico: artificial intelligence al servizio dei pazienti
I progressi degli ultimi anni nell’oncologia di precisione hanno portato a una maggiore richiesta di test predittivi che consentono la selezione e la stratificazione dei pazienti per il trattamento. L’approccio “semplicistico” che consiste nel correlare ad ogni tumore un marcatore o un gene singoli si è scontrato con l’evidenza di una vasta eterogeneità che è possibile già riscontrare al microscopio a partire dalla complessa interazione tra le cellule neoplastiche, il sistema immunitario e l’impalcatura tissutale sulla quale si sviluppa il cancro (stroma). Per meglio studiare il microambiente tumorale l’analisi morfometrica mediante strumenti informatici (image analysis e artificial intelligence) su vetrini digitali è stata largamente impiegata per comprendere subdole alterazioni non visibili ad occhio nudo19.
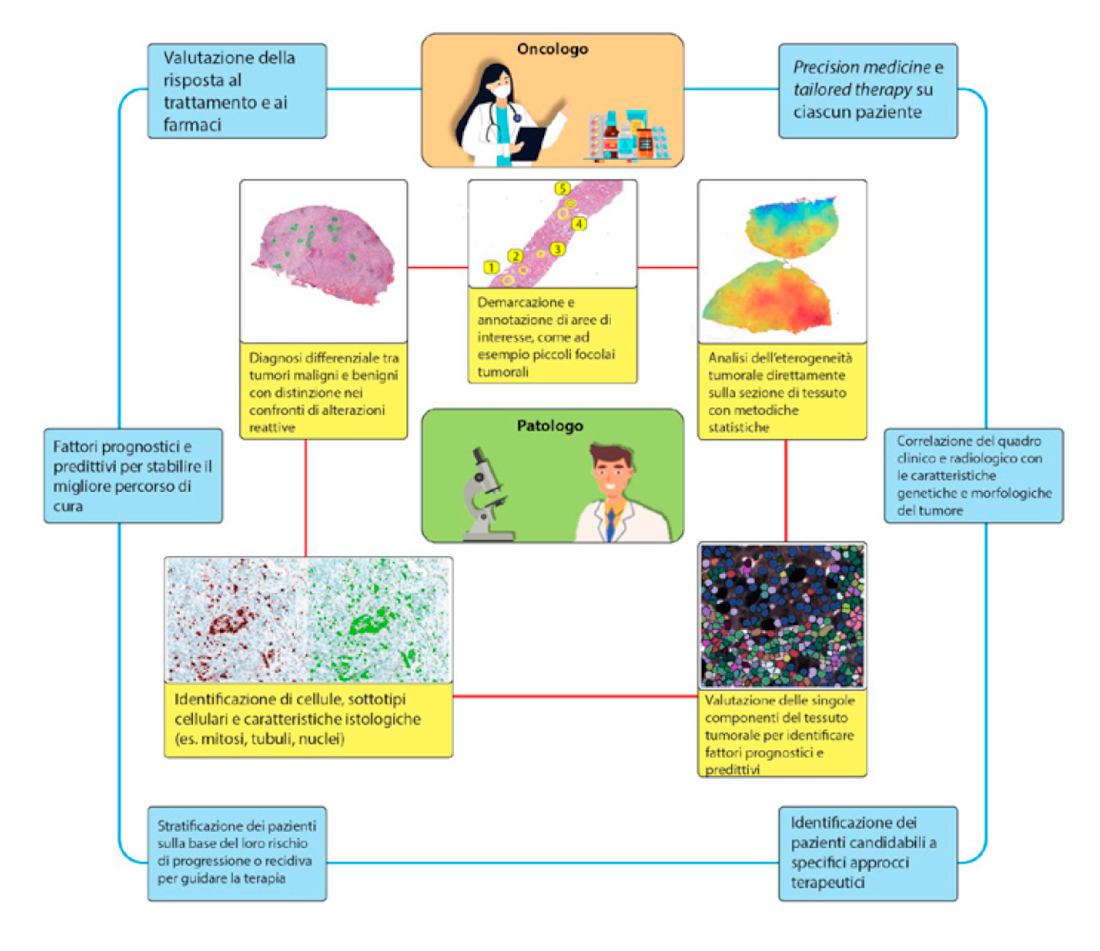
Con il termine artificial intelligence si intende una vasta branca dell’informatica che permette di fare delle previsioni sulla base di dati estratti, ad esempio da immagini statiche o dinamiche (vetrino virtuale), in maniera “intelligente” come farebbe una mente umana. Questo tipo di approccio applicato alla patologia ha permesso di dimostrare le capacità della macchina di prevedere la natura benigna o maligna di una lesione neoplastica20, di valutare l’eventuale valore prognostico di alcune alterazioni del tessuto (es. morfologia dei nuclei)21, di individuare modifiche cellulari che possano predire la risposta o la resistenza a specifici trattamenti oncologici22. Nella Figura 2 sono schematizzati alcuni dei possibili utilizzi e risvolti dell’artificial intelligence nell’ambito della patologia e dell’oncologia di precisione.
Figura 2: Possibili ambiti applicativi dell’artificial intelligence nella valutazione del paziente oncologico. Modificato da Nat Rev Clin Oncol. 2019; 16(11): 703–715.
Bibliografia
1. Niazi, M. K. K., Parwani, A. V. & Gurcan, M. N. Digital pathology and artificial intelligence. Lancet Oncol. 20, e253–e261 (2019).
2. Diagnosi a distanza dall’Italia all’Africa: ecco i Patologi oltre frontiera. https://www.redattoresociale.it/article/i_numeri/diagnosi_a_distanza_dall_italia_all_africa_ecco_i_patologi_oltre_frontiera.
3. Farahani, N. & Pantanowitz, L. Overview of Telepathology. Clin. Lab. Med. 36, 101–112 (2016).
4. Evans, A. J. et al. US Food and Drug Administration Approval of Whole Slide Imaging for Primary Diagnosis: A Key Milestone Is Reached and New Questions Are Raised. Arch. Pathol. Lab. Med. 142, 1383–1387 (2018).
5. Evans, A. J., Krupinski, E. A., Weinstein, R. S. & Pantanowitz, L. 2014 American Telemedicine Association clinical guidelines for telepathology: Another important step in support of increased adoption of telepathology for patient care. J. Pathol. Inform. 6, 13 (2015).
6. Lovitch, S. B. & Rodig, S. J. The Role of Surgical Pathology in Guiding Cancer Immunotherapy. Annu. Rev. Pathol. 11, 313–341 (2016).
7. Pagni, F. et al. Digital Pathology and PD-L1 Testing in Non Small Cell Lung Cancer: A Workshop Record. Cancers 12, (2020).
8. Griffin, J., Kitsanta, P., Perunovic, B., Suvarna, S. K. & Bury, J. Digital pathology for intraoperative frozen section diagnosis of thoracic specimens: an evaluation of a system using remote sampling and whole slide imaging diagnosis. J. Clin. Pathol. 73, 503–506 (2020).
9. Thorstenson, S., Molin, J. & Lundström, C. Implementation of large-scale routine diagnostics using whole slide imaging in Sweden: Digital pathology experiences 2006-2013. J. Pathol. Inform. 5, 14 (2014).
10. Hanna, M. G. et al. Validation of a digital pathology system including remote review during the COVID-19 pandemic. Mod. Pathol. 33, 2115–2127 (2020).
11. Center for Devices & Radiological Health. Digital Pathology Devices Policy During COVID-19. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/enforcement-policy-remote-digital-pathology-devices-during-coronavirus-disease-2019-covid-19-public (2020).
12. Hamilton, P. W., Wang, Y. & McCullough, S. J. Virtual microscopy and digital pathology in training and education. APMIS 120, 305–315 (2012).
13. Samueli, B., Sror, N., Jotkowitz, A. & Taragin, B. Remote pathology education during the COVID-19 era: Crisis converted to opportunity. Ann. Diagn. Pathol. 49, 151612 (2020).
14. Pell, R. et al. The use of digital pathology and image analysis in clinical trials. Hip Int. 5, 81–90 (2019).
15. Roque, R., Henrique, H. & Aguiar, P. Preanalytic errors in anatomic pathology: study of 10,574 cases from five Portuguese hospitals. Diagnosis (Berl) 2, 181–188 (2015).
16. Linee guida sulla Tracciabilità, Raccolta, Trasporto, Conservazione e Archiviazione di cellule e tessuti per indagini diagnostiche di ANATOMIA PATOLOGICA – Consiglio superiore di Sanità – Ministero della salute 2015 (http://www.salute.gov.it/portale/documentazione/p6_2_2_1.jsp?lingua=italiano&id=2369).
17. Fraggetta, F., Garozzo, S., Zannoni, G. F., Pantanowitz, L. & Rossi, E. D. Routine Digital Pathology Workflow: The Catania Experience. J. Pathol. Inform. 8, 51 (2017).
18. Fraggetta, F., Rossi, E. D. & Pantanowitz, L. Advocating a Laboratory Information System-Centric Approach to Digital Pathology. Archives of pathology & laboratory medicine vol. 142 434 (2018).
19. Bera, K., Schalper, K. A., Rimm, D. L., Velcheti, V. & Madabhushi, A. Artificial intelligence in digital pathology – new tools for diagnosis and precision oncology. Nat. Rev. Clin. Oncol. 16, 703–715 (2019).
20. Cai, T. Breast cancer diagnosis using imbalanced learning and ensemble method. Appl. Comput. Math. 7, 146 (2018).
21. Veta, M. et al. Prognostic value of automatically extracted nuclear morphometric features in whole slide images of male breast cancer. Mod. Pathol. 25, 1559–1565 (2012).
22. Wang, X. et al. Computer extracted features of cancer nuclei from H&E stained tissues of tumor predicts response to nivolumab in non-small cell lung cancer. J. Clin. Oncol. 36, 12061–12061 (2018).