15. Farmaci e vaccini per Covid-19; opportunità e criticità per i pazienti oncologici
a cura di C. Tomino – IRCCS San Raffaele, Roma
Il virus SARS-CoV-2
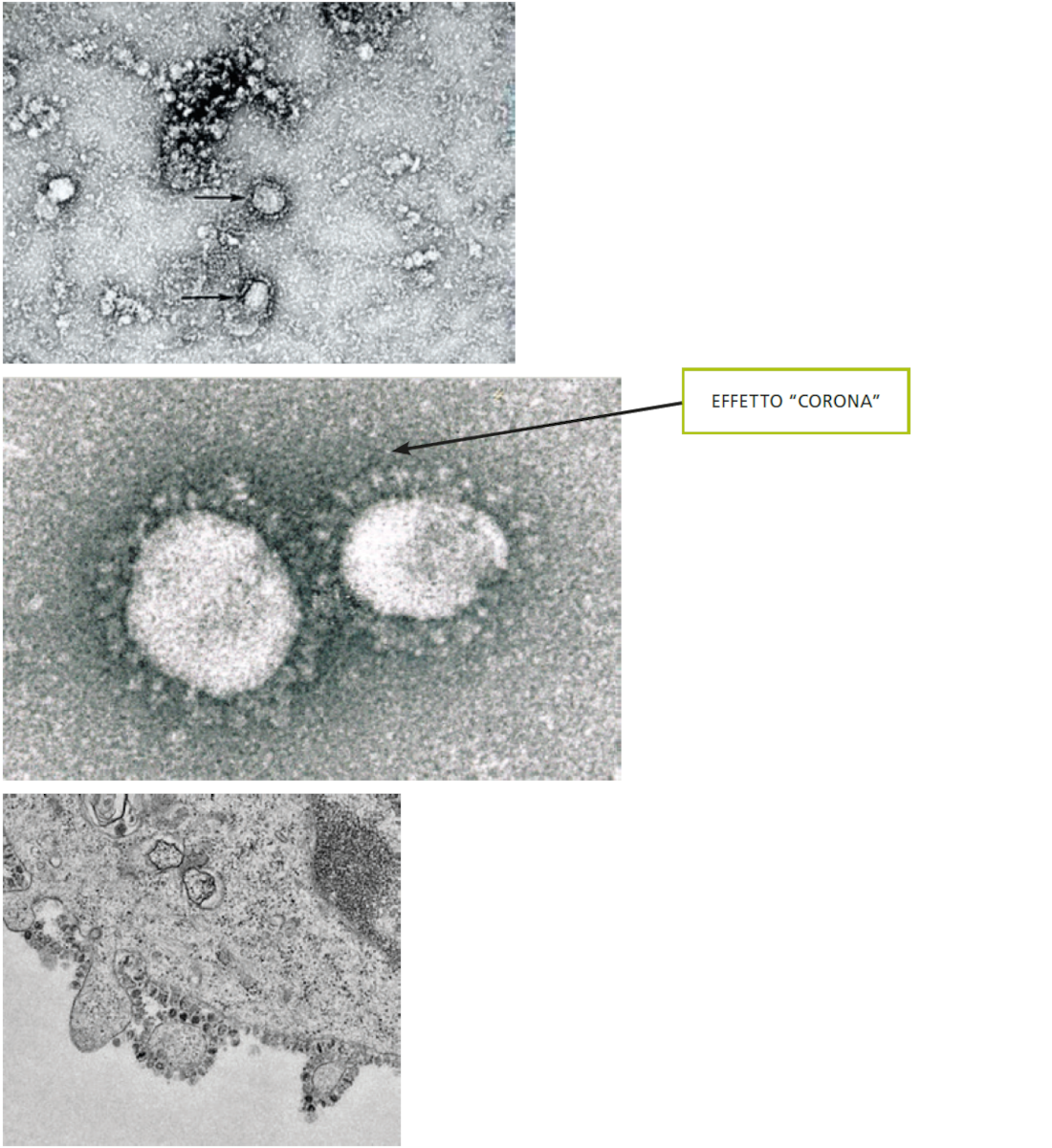
Il virus SARS-CoV-2 fa parte dell’ampia famiglia dei Coronavirus che provocano malattie che vanno dal comune raffreddore invernale a malattie molto più gravi come la Sindrome Respiratoria del Medio Oriente (MERS) e la Sindrome Respiratoria Acuta Grave (SARS). Questi tipi di virus si chiamano così perché i loro virioni (la parte infettiva) appaiono al microscopio elettronico come piccoli globuli, sui quali ci sono tante piccole punte proteiche che ricordano quelle di una corona.
Una di queste “punte” conosciuta come Spike (S) ha la funzione di ancorarsi alle cellule dell’organismo umano permettendo l’ingresso del virus. Una volta che il virus è entrato dentro la cellula umana, l’RNA virale (acido ribonucleico) viene immediatamente tradotto dalla cellula infetta in proteine virali. Successivamente, la cellula infetta muore liberando milioni di nuove particelle virali.
A questo punto, l’organismo ospite (uomo), attiva una risposta immunitaria. Il quadro clinico legato alla presenza del virus e alla sua replicazione e, probabilmente, anche alla reazione immunitaria che l’organismo umano sviluppa contro il virus, sono molto variabili.
Si calcola che nel 70% dei pazienti la malattia sia asintomatica o con sintomi molto lievi (raffreddore, dolori muscolari, oculorinite), mentre nel restante 30% si ha una sindrome respiratoria con febbre elevata, tosse, fino a raggiungere l’insufficienza respiratoria grave che può richiedere il ricovero in terapia intensiva.
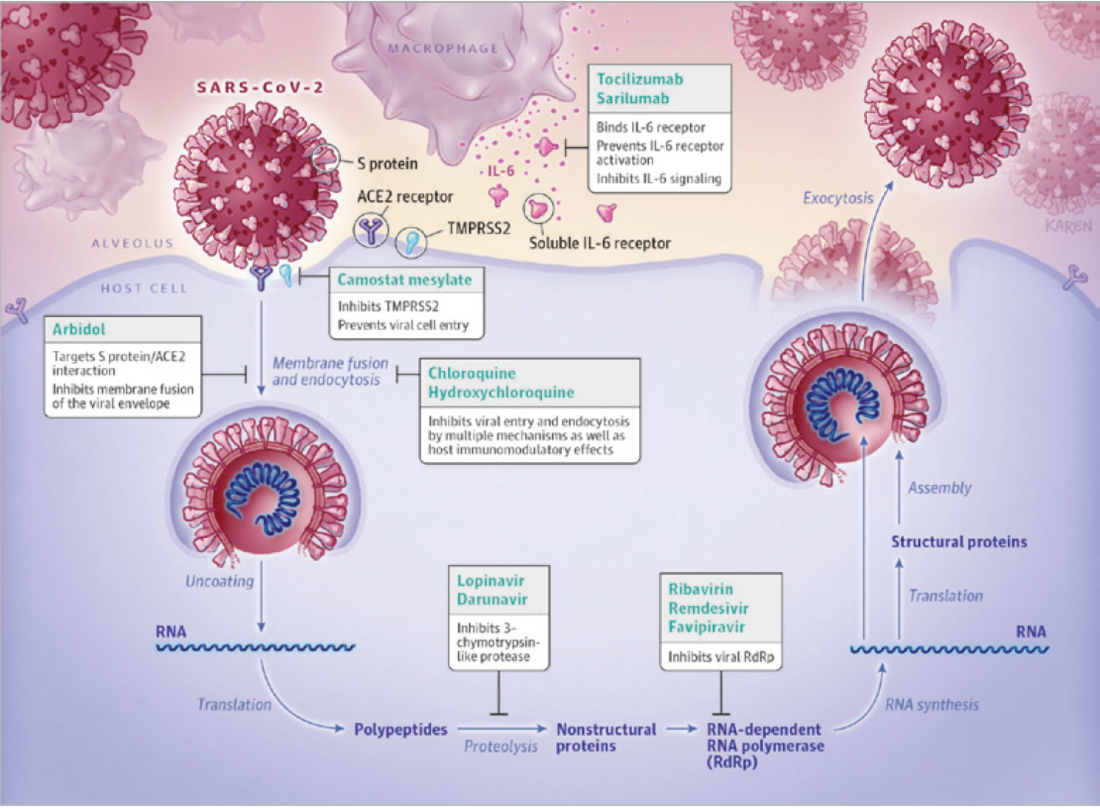
I farmaci finora utilizzati nell’infezione da SARS-Cov2 sono molteplici e cercano di aggredire il ciclo di replicazione virale in diversi passaggi “critici”
Il ciclo replicativo del Covid-19
(Estratto da: Pharmacologic Treatments for Coronavirus Disease 2019 (COVID-19). Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. [JAMA published online ahead of print, 2020 Apr 13]. JAMA. 2020;10.1001/jama.2020.6019. doi:10.1001/jama.2020.6019)
L’unico farmaco registrato dall’EMA a Giugno del 2020 (al netto dell’utilizzo di alcuni anticorpi monoclonali, in particolar modo Lilly e Regeneron) è il REMDESIVIR (Veklury®) 100 mg, soluzione per infusione. Si tratta di un antivirale studiato per Ebola; è indicato per il trattamento di adulti e adolescenti (>12a e >40kg) positivi a Covid-19 con polmonite che richiede ossigenoterapia supplementare. Si tratta, in buona sostanza, di un profarmaco, analogo nucleotidico dell’adenosina che viene metabolizzato nelle cellule ospiti per formare il metabolita trifosfato nucleosidico farmacologicamente attivo.
Tra i farmaci che fanno parte del protocollo di trattamento standard all’interno dei repartiCovid possiamo menzionare sicuramente il Desametasone (cortisonico); dati preliminari derivanti dallo studio Recovery indicano che nei 2.104 pazienti trattati con desametasone 6mg/die vs terapia standard, la terapia ha ridotto il tasso di mortalità a 28 giorni del 17%, con il massimo beneficio tra i pazienti che richiedevano ventilazione.
Anche le Eparine a Basso Peso Molecolare (EBPM) vengono ormai utilizzate nella profilassi del tromboembolismo venoso post chirurgico e del tromboembolismo venoso in pazienti non chirurgici affetti da una patologia acuta e mobilità ridotta. Nella fase avanzata da COVID-19 è stata osservata un’alterazione progressiva di alcuni parametri infiammatori e coagulativi. Un’analisi retrospettiva su 415 casi di polmonite grave in corso di COVID-19, ha suggerito che nei pazienti in cui si dimostra l’attivazione della coagulazione, la somministrazione di eparina per almeno 7 giorni ha determinato un vantaggio in termini di sopravvivenza.
L’utilizzo delle EBPM si colloca quindi:
- nella fase iniziale della malattiaquando è presente una polmonite e si determina un’ipomobilità del paziente con allettamento, come profilassi del tromboembolismo venoso;
- nella fase più avanzata, in pazienti ricoverati per contenere i fenomeni trombotici a partenza dal circolo polmonare come conseguenza dell’iperinfiammazione.
Di un certo interesse è anche l’utilizzo del Plasma iperimmune (Immunoterapia passiva con plasma derivato da pazienti guariti dall’infezione da SARS-CoV-2). L’obiettivo è quello di trasferire il plasma da una persona guarita da COVID-19 per neutralizzare il virus nel sangue dei pazienti malati e/o ridurre le probabilità che l’infezione peggiori. Una prima revisione sistematica (aprile 2020) ha analizzato i 5 studi disponibili e, seppure le evidenze sono limitate, le conclusioni possono essere cosi riassunte: in quasi tutti i pazienti si è avuto la clearance del SARS-CoV-2
l’infusione di plasma donato da soggetti guariti può ridurre la mortalità nei pazienti critici.
In Europa, la Commissione Europea sta collaborando con gli Stati membri, l’European Blood Alliance (EBA), il Centro europeo per la prevenzione e il controllo delle malattie (ECDC) e altri professionisti competenti in materia per sostenere lo studio “SUPPORTing high quality evaluation of COVID-19 convalescent Plasma throughout Europe” (all’interno del progetto “Horizon 2020”, 9 Paesi Membri coinvolti e durata di 24 mesi). Anche in Italia è in corso uno studio, coordinato dall’Azienda ospedaliero-universitaria pisana, che dovrebbe dare risultati nei prossimi mesi.
Esistono altre terapie essenziali per mantenere in vita il paziente in attesa che altri farmaci siano efficaci o che la malattia guarisca spontaneamente. Ne fanno parte:
- l’ossigenoterapia a bassi o alti dosaggi;
- la ventilazione a pressione positiva non invasiva (NIV);
- la ventilazione meccanica mediante
In casi estremi può essere attuata la extra corporeal membrane oxygenation (ECMO) che consiste nel sostituire l’azione polmonare di ossigenazione utilizzando una procedura di circolazione extracorporea aumentando, così, l’ossigenazione del sangue.
Sono moltissime (oltre 1000 dai dati di Clinicaltrial.gov) poi le sperimentazioni cliniche condotte a livello mondiale su farmaci (vecchi e nuovi ) giunte nelle diverse fasi di sviluppo.
Solo per elencarne alcuni, possiamo ricordare la categoria degli Antimalarici (Idrossiclorochina e
Colchicina), gli Immunosoppressori (Mabs usati nell’artrite reumatoide, quali Tocilizumab,
Sarilumab, Emapalumab, Maurilimumab), Inibitori della Tirosin Chinasi (Tofacitinib, Acalabrutinib
Opaganib, Ruxolitinib, Baricitinib), Antiprotozoari (usati nella pediculosi, es. Ivermectina) e poi Interferone Beta, Defibrotide, Selinexor e si potrebbe continuare a lungo.
I vaccini contro il Covid-19
Abbastanza analogo è il discorso per i vaccini. Come sappiamo, il percorso per sviluppare i vaccini è ormai consolidato e standardizzato a livello mondiale; sostanzialmente si identificano 3 fasi di sviluppo:
Fase I: prima somministrazione del vaccino sull’uomo per valutare la tollerabilità e la sicurezza del prodotto (il numero dei soggetti coinvolti è molto ridotto)
Fase II: se la fase I ha mostrato risultati positivi, il vaccino viene somministrato ad un numero maggiore di soggetti (sempre esiguo) per valutare la risposta immunitaria prodotta, la tollerabilità, la sicurezza e definire le dosi e i protocolli di somministrazione più adeguati.
Fase III: se la fase II ha mostrato risultati soddisfacenti, il vaccino viene somministrato a un numero elevato di persone allo scopo di valutare la reale funzione preventiva del vaccino.
Tutti i vaccini, a prescindere dalla loro tipologia, una volta somministrati hanno come obiettivo comune quello di stimolare il sistema immunitario alla produzione di anticorpi specifici in modo che, ad un futuro contatto con il virus il nostro organismo sia già in grado di produrre delle difese.
Per SARS-Cov2, si identificano 3 grandi famiglie di vaccini:
- Vaccini a mRNA (o DNA)
L’RNA messaggero che codifica la proteina Spike (S) di Sars-Cov2 è incapsulato in nanoparticelle lipidiche, in modo tale che la molecola possa entrare direttamente nelle cellule dove quindi viene prodotto l’antigene. Fanno parte di questa famiglia i vaccini già disponibili Comirnaty (Pfizer), mRNA1273 (Moderna) e altri che sono in fase di sviluppo.
- Vaccini basati su vettori virali
Vengono sfruttati dei virus (spesso Adenovirus) che sono modificati geneticamente in modo tale che ‘trasportino’ il gene che codifica la proteina S. Fanno parte di questa famiglia i vaccini Vaxzevria (Astra Zeneca), Janssen Covid-19 Vaccine (Johnson & Johnson), e altri che sono in fase di sviluppo clinico.
- Vaccini composti da SARS-Cov2-inattivato
Vaccini con tecnica tradizionale (si tratta di inoculare una piccola dose di virus inattivato); SinoVac e Sinopharm (Cina), al momento nom disponibili in Italia.
Interazioni dei vaccini con altri farmaci
L’efficacia, la sicurezza e l’immunogenicità del vaccino non sono state valutate nei soggetti immunocompromessi, compresi quelli in terapia immunosoppressiva; tuttavia, l’efficacia dei vaccini potrebbero essere inferiori nei soggetti immunocompromessi.
Per quanto riguarda le interazioni con altri medicinali ed altre forme d’interazione, queste non sono state studiate in modo esteso, per cui potenzialmente non possono essere escluse.
Anche a fronte di potenziali interazioni, che ad oggi tuttavia non si sono studiate a fondo, va ribadito che i malati di tumore si possono e debbono vaccinarsi. E’ opportuno fare una distinzione tra i pazienti non in terapia attiva, cioè quelli che sono guariti e hanno concluso il loro iter terapeutico, e i pazienti che sono in terapia e hanno una malattia ancora attiva. Questi ultimi sono indubbiamente i pazienti più potenzialmente a rischio, immunodepressi, e quindi dovrebbero avere la precedenza nell’accesso al vaccino. I pazienti guariti e in follow-up, invece, possono seguire le regole generali sull’ordine di accesso, anche in rapporto al numero di vaccini che saranno disponibili nei prossimi mesi. Va in ogni caso sottolineato che non vi sono assolutamente controindicazioni alla vaccinazione.
Per quanto riguarda la categoria dei pazienti immuno-compromessi (non solo oncologici) la vaccinazione dovrebbe essere, a maggior ragione obbligatoria. Anche se gli studi fatti finora sui vaccini anti-COVID-19 hanno escluso i pazienti immuno-compromessi, e quindi non si hanno dati a disposizione sul loro impatto, è possibile basarsi sull’esperienza fornita da altre vaccinazioni: il rischio più grande che possono correre questi pazienti è che il vaccino sia meno efficace. Se il vaccino è meno efficace, tuttavia, risulta ridotto anche il rischio di tossicità, quindi in ogni caso non si corre alcun pericolo, al massimo avrà una minor efficacia.
Va con forza ribadito che non esistono vaccini che possono indurre un rischio maggiore di sviluppare tumori.
I vaccini hanno salvato finora milioni di persone dalle più diverse patologie; esistono quindi fondate certezze che anche i vaccini anti-COVID-19 possano contribuire a ridurre sensibilmente la pandemia che dall’inizio del 2020 affligge l’intera popolazione mondiale.
Scarica questo capitolo in PDF:
13° Rapporto - Capitolo 15
Farmaci e vaccini per Covid-19; opportunità e criticità per i pazienti oncologici