3. La gestione multidisciplinare può essere un LEA?
a cura di A. Cicchetti – Università Cattolica del Sacro Cuore, Milano
Introduzione
L’evoluzione della scienza biomedica offre ai medici la possibilità di garantire ai pazienti soluzioni e tecnologie sempre più innovative ed efficaci. Terapie geniche curative, farmaci biologici, dispositivi medici impiantabili, chirurgia robotica fino alla digitalizzazione e all’intelligenza artificiale, stanno cambiando lo scenario nel sistema delle cure, generando promesse per gli operatori sanitari e speranze per i pazienti.
Tutta questa innovazione ha un costo e ci si trova spesso a parlare di “sostenibilità” dei sistemi sanitari a livello globale. Il Servizio sanitario nazionale è tra i pochi a livello europeo ad aver mantenuto un’impronta universalistica anche se l’accessibilità ai servizi, ma anche la loro qualità, conosce alti e bassi a seconda delle Regione in cui ci si trova. In realtà, a ben vedere, la variabilità degli esiti – testimoniata anche quest’anno dai risultati del Programma Nazionale Esiti e da diverse iniziative “indipendenti” che informano pazienti e cittadini sulla “qualità” dei luoghi di cura – esiste anche all’interno della singola Regione e, qualche volta, anche all’interno della stessa azienda sanitaria.
Volendo guardare un po’ più a fondo scopriamo che in realtà non si riscontrano correlazioni forti tra quantità di risorse disponibili e esiti di salute. In buona sostanza la variabilità degli esiti clinici solo in parte dipende dal livello di “innovatività” dei farmaci disponibili o dalla presenza più o meno massiccia di robot chirurgici.
È evidente che il “fattore umano” è fondamentale, ma a ben vedere non basta più il “luminare” per ottenere i migliori risultati nelle cure, almeno nella medicina di oggi.
Se nel 1970 erano sufficienti in media 2 professionisti per trattare un paziente in un ospedale, oggi per trattare lo stesso paziente abbiamo bisogno delle competenze di 15 diversi professionisti, ciascuno con una formazione meno ampia, ma più profonda.
In un oramai famoso “Ted Talk” del 2012, Atul Gwande, chirurgo generale al Brigham and Women Hospital di Boston ed “inventore” della check list in chirurgia (quando era esperto presso il WHO a Ginevra), sosteneva che per “salvare la medicina” l’arma fondamentale fosse proprio il medico. Atul parla di una nuova figura di professionista chiamata a sviluppare tre competenze: la capacità di valutare e misurare fenomeni critici (errori, sprechi, ecc.), la ricerca delle soluzioni in merito ai problemi che ogni giorno si affrontano sotto il profilo della gestione e infine la capacità di implementare le soluzioni grazie al lavoro di gruppo. L’esempio eclatante che Gwande riporta nel suo video di 18 minuti è quello delle check list per la chirurgia di derivazione aeronautica. Se la variabilità degli esiti in chirurgia è il “fenomeno”, la check list che lui stesso ha progettato per il WHO è lo strumento, e la diffusione del suo utilizzo è ciò che effettivamente può fare la differenza. Solo così è possibile ridurre la mortalità in sala operatoria di oltre il 47% (questi i dati dello studio pubblicato nel 2011 (Ziewacz et al. 2011). Non esistono farmaci che da soli garantiscano tali risultati!
A pensarci bene quello che Gwande ha detto, e che in molti altri stanno sempre più dimostrando, è che l’arma essenziale per la migliore cura sia proprio la buona organizzazione del lavoro. Un recente articolo comparso sul prestigioso British Medical Journal (Fulop, 2019) offre una revisione di un’ampia letteratura che testimonia un fenomeno che in parte ci rincuora, e in parte ci rattrista. Ci rincuora perché ci dice che c’è un modo relativamente a buon mercato per migliorare la qualità delle cure: basta imparare a lavorare insieme in modo multidisciplinare. Al tempo stesso, però, rattrista perché mette a nudo i limiti della nostra medicina tradizionale, quella centrata sul singolo professionista, quella figura spesso eroica del medico che si oppone all’esito infausto della malattia per il bene supremo del paziente. Ci rattrista perché ci mostra come in tutti quei luoghi dove non si lavora in modo coordinato e come una squadra, non solo si consumano più risorse ma si riducono le possibilità di sopravvivenza delle persone.
Lavorare in “rete”, lavorare insieme
In Italia il lavoro in “rete”, soprattutto in oncologia, si sta diffondendo rapidamente anche se, purtroppo, a macchia di leopardo senza un preciso gradiente nord-sud e in modo differenziato in relazione agli ambiti della patologia.
Nell’ambito della presa in carico e del trattamento delle donne affette dai tumori del seno, ad esempio, l’attenzione sui temi dell’organizzazione del lavoro multiprofessionale è di lunga data e risale ai primi anni 2000. Ma è nel 2014 che è stato raggiunto un primo momento di svolta allorquando sono state emanate le “Linee di indirizzo sulle modalità organizzative ed assistenziali della rete dei Centri di Senologia”, parte integrante della intesa sancita il 18 dicembre 2014 fra Governo, le Regioni e le Province Autonome di Trento e Bolzano, nella quale si impegnano a recepirne i contenuti tecnici e il percorso della assistenza alla paziente affetta da tumore al seno entro 6 mesi dalla stipula. Il documento di cui all’intesa fra Governo e Regioni definisce il Centro di Senologia come “un modello di assistenza specializzato nella diagnosi, cura e riabilitazione psicofisica delle donne affette da carcinoma mammario dove la gestione del percorso della paziente è affidato ad un gruppo multidisciplinare di professionisti dedicati e con esperienza specifica in ambito senologico”.
Più recentemente nel 2017 il Centro di Senologia, come modello assistenziale, è entrato a far parte dei Livelli Essenziali di Assistenza (Gazzetta Ufficiale n° 65 supplemento ordinario n°15) e del documento Stato – Regioni sulle reti oncologiche n°59 del 17/04/2019.
È evidente che queste previsioni forniscono un quadro regolatorio importante ma pur garantendo indicazioni sui requisiti infrastrutturali, tecnologici ed organizzativi del centro di senologia non assicurano la piena implementazione di tali criteri in tutte le regioni in modo omogeneo e, in secondo luogo, non dedicano specifica attenzione alla presenza di una vera e propria “tumord board review” per tutte le pazienti affette da tale patologia.
Una recente analisi sviluppata dall’associazione dell’Associazione Senonetwork Italia (www.senonetwork.it) ha messo in evidenza che su 122 centri di senologia considerati il lavoro multidisciplinare appare ampiamente diffuso; la stessa analisi ha però evidenziato che solo 21 di questi centri hanno una certificazione riconosciuta a livello europeo, quella dell’European Society of Breast Cancer Specialists (EUSOMA) che assicura, invece, una piena integrazione tra le figure professionali in processi di presa in carico realmente multidisciplinari.
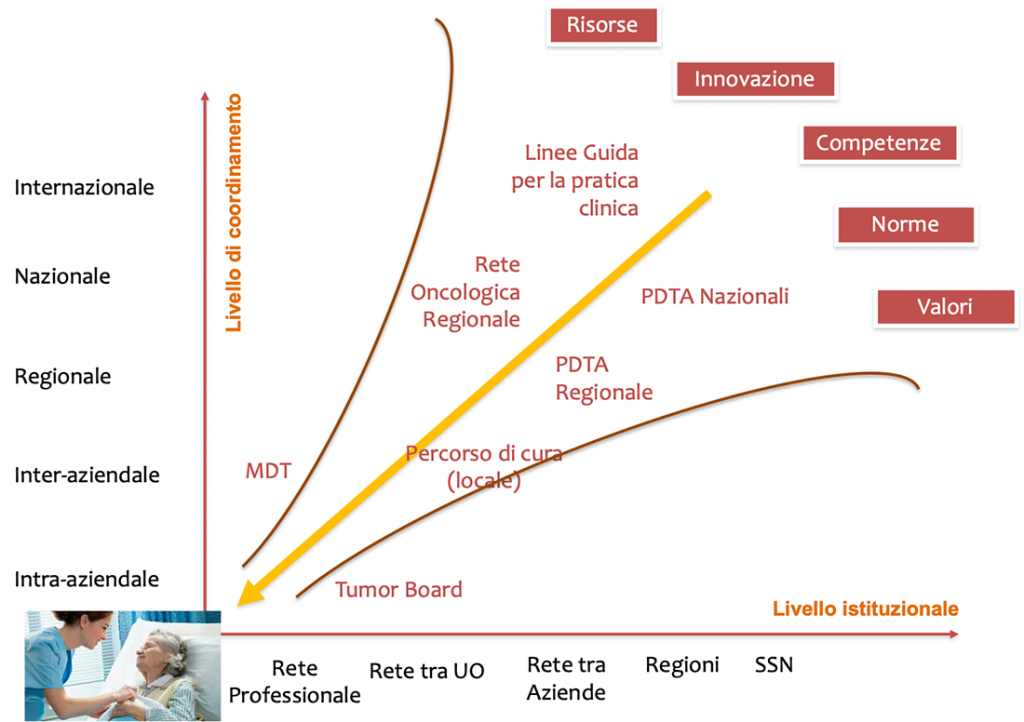
Quanto descritto nel caso del tumore al seno, non è riscontrabile in altri ambiti dell’oncologia. Certamente grazie al Decreto Ministeriale 70 del 2015, le Regioni – ove più ove meno – hanno avviato sforzi importanti per realizzare reti cliniche e percorsi diagnostico terapeutici (PDTA) che in qualche modo “spingono” a lavorare in modo integrato e multidisciplinare in tutti gli ambiti dell’oncologia. Il livello di implementazione di queste raccomandazioni e la reale efficacia di tali interventi appare variabile da contesto a contesto e non è facilmente misurabile. La reale trasformazione organizzativa di cui c’è bisogno è quella che permette di portare al letto del paziente e per tutti i casi che ne necessitano, tutte le competenze integrate in un unico processo di revisione della condizione patologica per la migliore scelta del percorso e delle tecnologie disponibili in accordo con le preferenze del paziente (Fedi figura 1).
Figura 1. Il “sistema” della medicina
Laddove esistono regole di rete ben delineate e percorsi di diagnosi e cura non necessariamente si giunge ad una piena integrazione dell’assistenza e ad una reale presa in carico del caso in senso multiprofessionale. Come ho già avuto modo di argomentare altrove (Cicchetti, 2018) non è sufficiente definire formalmente una “forma organizzativa a rete per la pratica clinica” (il clinical network o il managed clinical network) per ottenere quello che in realtà è atteso: ovvero lo sviluppo di una vera “comunità di pratiche” (CoP). Una CoP è una comunità di professionisti collegati tra loro per condividere conoscenze specifiche, convergenti verso l’adozione di un linguaggio e un’identità comuni (Wenger, 1998). Nel caso dell’oncologia il tumor board rappresenta l’approccio più appropriato per trasformare una gruppo di professionisti in una vera e propria comunità di pratiche conseguendo tutti i benefici derivanti da questa specifica forma di organizzazione del lavoro.
Ecco che da qui emerge la definizione di ciò a cui si deve puntare ovvero la creazione di un team multidisciplinare e multiprofessionale che realizza sistematicamente una “tumor board review” (TBR). Secondo il National Institutes of Health, la TBR viene condotta quando team di medici esperti si incontrano per esaminare e discutere i casi di pazienti complessi con una diagnosi di cancro. Si tratta di un approccio di pianificazione del trattamento in cui un certo numero di medici esperti in diverse specialità mediche riesamina e discute le condizioni cliniche e le opzioni di trattamento disponibili. Nel trattamento del cancro, una TBR può includere molteplici professionisti tra cui, in genere, un oncologo medico, un oncologo chirurgico e un radioterapista. La definizione di tumor board (TB) fornita dall’American Society of Clinical Oncology sottolinea però due ulteriori aspetti importanti: ciò che caratterizza l’azione di un tumor board è (i) in primo luogo la sistematicità e la regolarità dell’incontro dei diversi professionisti e (ii) la presenza di diverse specialità cliniche unitamente a quella di altri operatori sanitari con l’obiettivo di condividere conoscenza sul caso di un paziente affetto da patologia per delineare il migliore piano di cura da proporre alla singola persona (www.cancer.net). Su questo aspetto, che non vuole essere solo semantico, spesso si sottolinea la differenza tra il concetto di “multidisciplinary team” (MDT) / “disease management team” (DMT) e “tumor board”. Nell’economia di questo contributo le due espressioni saranno utilizzate in modo “intercambiabile” per effetto di una progressiva evoluzione che nella letteratura specialistica ha avuto il concetto di TB che è oramai andato a coincidere con quello di MDT/DMT.
Tra le forme strutturate di tumor board, i team multidisciplinari MDT/DMT, sono gruppi di persone afferenti a diverse specialità, che si incontrano in un determinato momento (in un luogo fisico o tramite sistemi virtuali) per discutere di casi specifici contribuendo in modo indipendente alle decisioni diagnostiche e terapeutiche che riguardano il paziente (Crooper, 2002; Brown et al., 2016). Due sono gli elementi caratterizzanti questa definizione sotto il profilo organizzativo: il primo riguarda il riferimento alla disponibilità alla cooperazione tra i professionisti che implica una revisione del tradizionale approccio alla pratica clinica fondato sul principio dell’autonomia dell’azione professionale e il secondo che prevede l’adesione a un processo decisionale fondato sulla centralità dell’evidenza scientifica come catalizzatore delle diverse prospettive professionali.
Il MDT/DMT, quindi, più che un insieme di strumenti da implementare si fonda su una condivisione culturale circa la superiorità dell’approccio “sistemico” alla gestione delle cure rispetto al più tradizionale modello decisionale centrato sulla “scienza e coscienza” del singolo professionista. Secondo l’EPAAC (European Partnership for Action Against Cancer), sono quattro gli elementi essenziali per l’efficacia complessiva del DMT:
- chiari obiettivi di cura condivisi nell’ambito dei membri del DMT;
- un approccio centrato sul paziente, con informazioni disponibili e comprensibili sugli aspetti clinici e psico-sociali del processo assistenziale, chiari canali di comunicazione tra il gruppo di cura, il paziente e familiari in grado di promuovere l’engagement.
- l’organizzazione interna del DMT, che stabilisce le adeguate forme di leadership clinica e di coordinamento operativo, identifica un unico punto di contatto per i pazienti e le famiglie, utilizza sistematicamente il confronto (benchmarking) per integrare in modo tempestivo nuove conoscenze, prevede risorse e tempo per i medici e gli altri operatori sanitari;
- banche dati condivise in grado di registrare decisioni cliniche, risultati e indicatori, facilitando la valutazione dei progressi e l’individuazione di aree di miglioramento;
Generalmente, i DMT riuniscono i diversi specialisti, come oncologi, chirurghi, radioterapisti, radiologi e anato-mopatologi coinvolti nella cura del paziente oncologico, con l’obiettivo di individuare la terapia piu adeguata per i singoli pazienti e di monitorarne l’evoluzione ai follow-up successivi (Flessig et al., 2006;). La letteratura scientifica ha ampiamente dimostrato che l’implementazione di team multidisciplinari in oncologia ha effetti positivi sull’aumento della sopravvivenza, inoltre recenti evidenze dimostrano che in più del 50% dei casi la diagnosi iniziale e stata modificata (Fennel et al, 2010; Croke et al., 2012; Taylor et al., 2010; Prades et al., 2015; Stone et al., 2018).
Per giungere una completa caratterizzazione della gestione integrata multidisciplinare ed efficace, due ulteriori aspetti devono però essere considerati. Il primo riguarda la disponibilità dei dati e delle informazioni. Appare fondamentale che nel momento in cui il caso viene discusso in una TBR, tutti i dati clinici e le evidenze utili alla migliore risoluzione del caso devono essere rese disponibili e fruibili in uno specifico momento e in quel dato luogo (fisico o virtuale). La digitalizzazione delle informazioni, da un lato, e le potenzialità dell’intelligenza artificiale appaiono quindi prospettive che non possono essere ignorate nella prospettiva della lotta al cancro basata su un lavoro di squadra come quello che si sta delineando. Tra gli elementi conoscitivi sempre più indispensabili ci sono quelli inerenti la caratterizzazione molecolare del tumore che permette la corretta selezione di terapie a bersaglio molecolare che garantiscono trattamenti realmente personalizzati.
Un ultimo aspetto, non certo per rilevanza, va ricordato. La gestione integrata del percorso di cura, informato dalle conoscenze specializzate e condivise, dalle informazioni dettagliate e analizzate in modo dinamico, deve essere realizzata nella piena condivisione con il paziente che a sua volta deve poter essere messo nelle migliori condizioni per poter prendere una decisione cosciente circa il percorso da intraprendere. Questo momento appare cruciale e le modalità di comunicazione e condivisione con le persone malate e i loro caregiver devono rappresentare la cifra distintiva dell’azione del buon TB.
La gestione integrata come LEA
Gli elementi che caratterizzano una reale gestione multidisciplinare secondo il modello del TB, come già sopra testimoniato, sono presenti in maniera molto differenziata sia tra aree territoriali che nelle diverse branche della patologia tumorale. In una recente analisi svolta da CERISMAS (Centro di Ricerca e Studi in Management Sanitario) dell’Università Cattolica di Roma, i cui risultati sono stati recentemente resi noti (Cicchetti et. al, 2020), abbiamo osservato situazioni “eccellenti” sia al nord che al sud del paese, e lo studio mette in evidenza il persistere di grandi variabilità nella “qualità” dell’organizzazione per la cura del cancro.
Purtroppo ancora oggi la “buona organizzazione” non è un LEA, ovvero un livello essenziale di assistenza. È come dire che pur esistendo una diritto costituzionale alla tutela della salute, non esiste un diritto a che questa tutela avvenga in un contesto organizzativo in grado di aumentare la probabilità di avere una buona cura. Come previsto dal DPCM 12 gennaio 2017, Livelli essenziali di assistenza (LEA) sono le prestazioni e i servizi che il Servizio sanitario nazionale (SSN) è tenuto a fornire a tutti i cittadini, gratuitamente o dietro pagamento di una quota di partecipazione (ticket), con le risorse pubbliche raccolte attraverso la fiscalità generale (tasse). Quindi i LEA possono essere configurati in termini di singole tecnologie (es. i farmaci), prestazioni comples-se (es. procedure chirurgiche), programmi di sanità pubblica (es. programma di screening) ma anche come interi servizi (es. i distretti sanitari). Da qui si evince che un modello organizzativo, in quanto caratterizzante il processo di erogazione di una prestazione, possa rientrare nella definizione di LEA. D’altronde alla luce di quanto previsto dall’art. 1 (cm 7) del D.lgs n. 229/1999, possono essere posti a carico del Servizio sanitario (e quindi divenire LEA) “le tipologie di assistenza, i servizi e le prestazioni sanitarie che presentano, per specifiche condizioni cliniche o di rischio, evidenze scientifiche di un significativo beneficio in termini di salute, a livello individuale o collettivo, a fronte delle risorse impiegate”. Il caso della gestione multidisciplinare appare eclatante sotto questo profilo; siamo infatti di fronte ad una tipologia assistenziale la cui superiorità rispetto a modelli alternativi (ovvero la gestione non multidisciplinare) in termini di efficacia, è ampiamente dimostrata nella letteratura scientifica potendo quindi mostrare elevati livelli di evidenza. Sotto il profilo del consumo delle risorse, pur in mancanza di specifici studi di costo-efficacia, appare evidente che la gestione multidisciplinare non implica la necessità di maggiori ed ingenti risorse, quanto, più che altro, di una riorganizzazione delle risorse già ampiamente disponibili.
In altri paesi Europei la rilevanza dell’integrazione organizzativa per la gestione delle persone con il tumore ha portato ad interventi normativi ed istituzionali ben precisi. Un esempio fra tutti è quello francese. Da 15 anni in Francia, grazie al Plan Cancer 2003-2007, è obbligatorio che il percorso clinico di una persona con un cancro sia gestita nell’ambito di un team multidisciplinare (https://www.e-cancer.fr/Plan-cancer/Les-Plans-cancer-de-2003-a-2013/Le-Plan-cancer-2003-2007). La dispensazione dei costosissimi farmaci oncologici da parte del farmacista dell’ospedale, è condizionata dalla presenza di una valutazione multidisciplinare che assicura il giusto percorso di cura e la scelta della terapia più appropriata in una visione olistica dei bisogni del paziente, come persona.
L’NHS britannico oltre ad istituzionalizzare un simile obbligo, ha investito nella definizione di linee di indirizzo chiare per la strutturazione e il funzionamento dei MDTs (www.ncin.org.uk/view?rid=136). Gli elementi per un team efficace per i colleghi inglesi risiedono in elementi essenziali da realizzare in tutti i contesti in cui si prendono in carico persone con un tumore:
- la corretta individuazione dei membri del team, la presenza di adeguate competenze, coinvolgimento e motivazione;
- la disponibilità di una infrastruttura fisica per le riunioni e di una adeguata piattaforma tecnologica per gliincontri in remoto e lo scambio di dati ed informazioni;
- una chiara organizzazione per la logistica delle riunioni, la pianificazione e la preparazione dei meeting, e la gestione delle attività post meeting (es. prenotazione servizi e prestazioni);
- la definizione di un processo decisionale clinico incentrato sul paziente;
- la governance della squadra, la raccolta dei dati l’analisi e l’audit.
Mentre alcuni di questi elementi hanno una valenza generale, altri aspetti devono essere definiti prendendo in considerazione il contesto istituzionale e socio-economico di riferimento rispetto al quale è opportuna una riflessione approfondita che riguardi lo specifico del nostro Ssn.
Gli obiettivi e le linee di indirizzo
Un gruppo di oncologi, radioterapisti, chirurghi, esperti di management sanitario, in accordo con FAVO (Federazione Italiana delle Associazioni di Volontariato in Oncologia che riunisce più di 500 entità associative) e Cittadinanzattiva, hanno condiviso gli elementi che dovrebbero caratterizzare una organizzazione efficacia per la cura delle persone affette da patologia tumorale, traducendoli in una sorta di “decalogo”. La definizione di una tale proposta prende le mosse da alcune premesse di fondo:
- La caratterizzazione bio-molecolare dei tumori, i farmaci a bersaglio molecolare, l’immunoterapia, le terapie geniche, i dispositivi medici, la chirurgia robotica e le nuove tecnologie per i trattamenti radioterapici, unitamente alla digitalizzazione e allo sviluppo dell’intelligenza artificiale, stanno cambiando lo scenario nel sistema delle cure in oncologia;
- Nell’ultimo decennio, per le persone affette da patologie oncologiche, miglioramenti nella prognosi e nella sopravvivenza insieme all’incremento delle “guarigioni” sono stati ottenuti grazie all’avanzamento nelle scienze mediche e all’innovazione tecnologica;
- La cura del cancro impone la disponibilità di competenze approfondite di diverse discipline mediche e un coordinamento tempestivo ed efficace che implica la collaborazione di molteplici professionalità sia in ambito prettamente clinico che in ambito farmaceutico e farmacologico, psicologico e delle professioni sanitarie;
- I “tumor board” e i “multidisciplinary team” (MDT) sono approcci oramai consolidati per la gestione integrata del percorso di cura;
- Il Decreto Ministeriale 70 del 2015 ha indirizzato le Regioni verso la costruzione di reti cliniche e la gestione attraverso i percorsi diagnostico terapeutici assistenziali (PDTA) che rappresentano elementi necessari ma non sufficienti per ottenere un appropriato coordinamento in una visione assistenziale globale del paziente;
- In Italia il lavoro in “team”, soprattutto in oncologia, si sta diffondendo rapidamente anche se, purtroppo, a macchia di leopardo e con modalità diverse tra centro e centro;
- I benefici dei tumor board e dei MDTs per l’efficacia delle cure, sono oramai testimoniati dalla letteratura scientifica internazionale (per una sintesi di veda BMJ 365/2019) in quanto strumenti in grado di garantire la creazione di una vera e propria “comunità di pratiche” (community of practice);
- Il SSN Italiano ha l’esigenza di adottare tutte quelle politiche in grado di conciliare l’accessibilità alle cure delle persone affette da cancro e la sostenibilità economica del sistema stesso: ciò impone da una parte un’analisi e una valutazione dei volumi di patologia e delle risorse richieste e dall’altra un’organizzazione in grado di facilitare la presa in carico multidisciplinare della persona malata e la gestione integrata di terapie volta a una sempre maggiore personalizzazione.
Su queste basi il gruppo ha lanciato una sfida alle istituzioni del Servizio sanitario nazionale in occasione della Conferenza internazionale “Organizing for Health” tenutasi il 12 settembre 2019 in occasione dei 10 anni di attività dell’Alta Scuola di Economia e Management dei Sistemi Sanitari della Facoltà di Economia dell’Università Cattolica del Sacro Cuore nel 2009. Il gruppo multidisciplinare ha offerto, in questo senso, la sua collaborazione al Ministro della Salute, Roberto Speranza e alla Conferenza Stato Regioni, per garantire che ogni persona con una patologia oncologica possa avere accesso alle migliori professionalità e alle terapie più innovative, nel contesto di un modello organizzativo definito “tumor board”. La sfida si gioca sulla realizzazione di 8 punti:
- Si ritiene che ogni persona affetta da tumore debba avere accesso alle migliori professionalità e tecnologie disponibili, selezionate in modo appropriato e nell’ambito di un sistema organizzativo in grado di contribuire al miglioramento degli esiti e al buon uso delle risorse;
- Il modello organizzativo che corrisponde a queste caratteristiche è quello del “tumor board”;
- Si ritiene, quindi, che ogni persona affetta da tumore, ed in particolare da patologie neoplastiche che richiedono processi assistenziali complessi, debba essere valutata per il suo programma diagnostico/terapeutico nell’ambito di un “tumor board”;
- L’attività del tumor board deve comprendere, ove opportuno, la valutazione multidisciplinare del profilo genetico-molecolare del tumore, che appare sempre più indispensabile per la diagnosi, la definizione della prognosi e la scelta della migliore strategia terapeutica;
- È considerato indispensabile definire puntualmente le caratteristiche infrastrutturali, tecnologiche, organizzative e professionali richieste ai centri clinici che istituiscono il tumor board descrivendo puntualmente un percorso di accreditamento che sia basato su strutture, processi e misurazione di esiti testimoniati da un appropriato sistema di indicatori;
- Più in particolare è indispensabile identificare le competenze professionali necessarie per l’istituzione di un tumor board che possa definirsi tale, le procedure operative e il loro livello di formalizzazione e informatizzazione, un valore soglia nei volumi dei casi trattati, un sistema di indicatori per valutarne efficacia ed efficienza e le rispettive risorse richieste;
- Il tumor board dovrebbe operare prendendo in considerazione la prospettiva dei pazienti grazie alla partecipazione di loro rappresentanti nella fase di disegno delle procedure e prevedendo appropriate modalità di comunicazione e coinvolgimento dei pazienti e dei caregiver negli snodi decisionali cruciali del percorso;
- Il tumor board, rappresentando l’elemento basilare per la gestione del PDTA di ogni singola patologia neoplastica, richiede di essere definito attraverso precise caratteristiche da dettagliare in linee di indirizzo nazionali, e potrebbe, soprattutto per le neoplasie più complesse, divenire un LEA – Livello Essenziale di Assistenza, a testimonianza del fatto che il diritto alla tutela della salute passa anche per una buona organizzazione del lavoro.
I firmatari di questo “statement” si sono impegnati a portare all’attenzione delle istituzioni del SSN e a quelle politiche, in particolare, queste esigenze affinché si possa identificare un adeguato percorso normativo, istituzionale e scientifico per il conseguimento dei punti di cui sopra.
Il XII Rapporto Favo 2020 offre l’occasione per approfondire quanto già per grandi linee identificato nello statement approvato a settembre 2019 ma soprattutto per dare nuovo vigore a questa iniziativa portata avanti nell’esclusivo interesse dei malati e dei loro familiari.
Bibliografia
- Cicchetti A. L’Organizzazione, la migliore medicina, in X Rapporto condizione assistenziale dei malati oncologici, 2018, FAVO, Roma
- Cicchetti A., De Belvis A.G., Giorgio L., Laurita R., Altini M. et al. L’importanza dell’organizzazione in oncologia: proposte operative per ottimizzare la gestione dei pazienti affetti da carcinoma polmonare non a piccole cellule, Speciali di AboutPharma, n.14 Dicembre 2019/Gennaio 2020.
- Croke JM, El-Sayed S. Multidisciplinary management of cancer patients: chasing a shadow or real value? An overview of the literature. Curr Oncol 2012;19(4):e232-8
- Cropper S, Hopper A, Spencer SA. Managed clinical networks. Arch Dis Child 2002;87(1):1-4
- Fennell ML, Das IP, Clauser S et al. The organization of multidisciplinary care teams: modeling internal and external influences on cancer care quality. J Natl Cancer Inst, Monogr; 2010(40):72-80. doi: 10.1093/jnci-monographs/lgq010
- Fleissig A, Jenkins V, Catt S, Fallowfield L. Multidisciplinary teams in cancer care: are they effective in the UK? Lancet Oncol 2006;7(11):935-43
- Fulop NJ, Ramsay AIG. How organisations contribute to improving the quality of healthcare. BMJ. 2019 May 2;365:l1773.
- Prades J, Remue E, van Hoof E, Borras JM. Is it worth reorganising cancer services on the basis of multidisciplinary teams (MDTs)? A systematic review of the objectives and organisation of MDTs and their impact on patient outcomes. Health Policy 2015;119(4):464-74
- Stone E, Rankin N, Kerr S et al. Does presentation at multidisciplinary team meetings improve lung cancer survival? Findings from a consecutive cohort study. Lung Cancer 2018 Oct;124:199-204
- Taylor C, Munro AJ, Glynne-Jones R et al. Multidisciplinary team working in cancer: what is the evidence? BMJ 2010;340:c951
- Wenger E. , Communities of practice: learning, meaning and identity, Cambridge University Press, New York 1998.
- Ziewacz JE, Arriaga AF, Bader AM, Berry WR, Edmondson L, Wong JM, Lipsitz SR, Hepner DL, Peyre S, Nelson S, Boorman DJ, Smink DS, Ashley SW, Gawande AA. Crisis checklists for the operating room: development and pilot testing. J Am Coll Surg. 2011 Aug;213(2):212-217
Allegato – Composizione del Gruppo “12 Settembre”
Americo Cicchetti (Economia, Università Cattolica del Sacro Cuore – ALTEMS)
Francesco De Lorenzo (Presidente FAVO)
Ruggero De Maria (Patologia Generale, Fondazione Policlinico “A. Gemelli” Irccs, Università Cattolica del Sacro Cuore)
Antonio Gasbarrini (Gastroenterologia, Fondazione Policlinico “A. Gemelli” Irccs, Università Cattolica del Sacro Cuore)
Antonio Gaudioso (Cittadinanzattiva)
Marco Montorsi (Chirurgia, Istituto Clinico Humanitas)
Alessandro Morabito (Oncologia, Istituto Nazionale Tumori IRCCS Fondazione G. Pascale)
Nicola Normanno (Oncologia e biologia cellulare, Istituto Nazionale Tumori IRCCS Fondazione G. Pascale)
Francesco Perrone (Oncologia, Istituto Nazionale Tumori IRCCS Fondazione G. Pascale)
Teresa Petrangolini (Patient Advocacy LAB, ALTEMS)
Carmine Pinto (Oncologia, Asl di Reggio Emilia, IRCCS Istituto in Tecnologie Avanzate e Modelli Assistenziali in Oncologia)
Giovanni Scambia (Ginecologia Oncologica, Fondazione Policlinico universitario “A. Gemelli” – Irccs, Università Cattolica del Sacro Cuore)
Giampaolo Tortora (Oncologia medica, Fondazione Policlinico universitario “A. Gemelli” – Irccs, Università Cattolica del Sacro Cuore)
Vincenzo Valentini (Radioterapia, Fondazione Policlinico universitario “A. Gemelli” – Irccs, Università Cattolica del Sacro Cuore)