11. La centralità del paziente ed evoluzione dei Patient-Reported Outcomes (PROs) nella sperimentazione e nella pratica clinica. PROFFIT – il nuovo strumento per misurare la tossicità finanziaria
a cura di F. Perrone – Unità Sperimentazioni Cliniche, Istituto Nazionale Tumori di Napoli / AIOM, M. Di Maio – Dipartimento di Oncologia, Università di Torino / AIOM, E. Iannelli – F.AV.O.
L’impiego dei patient-reported outcomes (PROs) consente al paziente di riportare direttamente, senza il “filtro” del medico o di altri operatori, la frequenza e l’intensità dei sintomi di malattia e delle eventuali tossicità della terapia, nonché la propria qualità di vita [1]. Negli ultimi anni, una vasta letteratura ha evidenziato i vantaggi dell’impiego dei PROs, sia nelle sperimentazioni cliniche che nella pratica clinica oncologica. Infatti, i possibili vantaggi associati all’impiego dei PROs sono numerosi, a cominciare dalla maggiore accuratezza nella descrizione dei sintomi e delle tossicità associate ai trattamenti. È stato documentato, in più lavori alcuni dei quali anche italiani, che le tossicità “soggettive” associate al trattamento anti-tumorale sono a rischio di sottostima e under-reporting da parte dei medici.[2]. Nell’ambito degli studi clinici, sia per le agenzie regolatorie che per le società scientifiche, l’adozione dei PROs e la valutazione della qualità di vita consentono di acquisire informazioni importanti, in aggiunta ai risultati degli altri endpoint comunemente impiegati in oncologia, per definire il reale valore dei trattamenti. Un confronto tra i trattamenti in studio in termini di qualità di vita consente, senza dubbio, di migliorare la comunicazione relativa ai rischi e ai benefici delle terapie che, dopo la conduzione dello studio e l’eventuale approvazione da parte delle autorità regolatorie, saranno disponibili nella pratica clinica. L’impatto positivo o negativo in termini di qualità di vita possono assumere un’importanza notevole nell’interpretazione complessiva del valore dei trattamenti, specialmente nei casi in cui il vantaggio in termini di efficacia (ad esempio in termini di prolungamento del controllo strumentale di malattia) sia modesto in termini assoluti e associato ad una dubbia rilevanza clinica.
Va ricordato che l’analisi della qualità di vita presenta diverse difficoltà metodologiche, sia per la scelta degli strumenti più adeguati e del timing della loro somministrazione, sia per la modalità di gestione degli inevitabili dati mancanti, che per la modalità di presentazione e di analisi dei risultati [3]. Nel 2018, è stata condotta una revisione sistematica che ha preso in considerazione tutti gli studi randomizzati di fase III, condotti con farmaci antitumorali in qualunque neoplasia solida, pubblicati nel periodo compreso tra il 2012 e il 2016 su 11 prestigiose riviste internazionali [4]. Obiettivi dell’analisi erano la descrizione della prevalenza della qualità di vita come endpoint negli studi randomizzati di fase III condotti in ambito oncologico, nonché la descrizione dell’under-reporting della qualità di vita nelle pubblicazioni relative agli studi in cui essa è compresa tra gli endpoint. Complessivamente, sono state incluse nell’analisi 446 pubblicazioni: la qualità di vita non risultava compresa tra gli endpoint dello studio in 210 casi, pari al 47.1% delle pubblicazioni. Nel dettaglio, la qualità di vita non risultava compresa nel 40.1% degli studi condotti in pazienti con malattia avanzata / metastatica, nel 39.7% degli studi profit e nel 53.6% degli studi no profit. Prendendo in considerazione le 231 pubblicazioni nelle quali la qualità di vita era endpoint secondario o esploratorio, i risultati di qualità di vita erano presenti nella pubblicazione in 143 casi (pari al 61.9%), risultando invece assenti nel rimanente 38.1% dei casi. Nel dettaglio, i risultati di qualità di vita non erano presenti nel 37.6% delle pubblicazioni di studi condotti in pazienti con malattia avanzata / metastatica, nel 37.1% delle pubblicazioni di studi profit e nel 39.3% delle pubblicazioni di studi non profit. Spesso la pubblicazione dei risultati di qualità di vita avviene in ritardo rispetto alla pubblicazione principale: considerando gli studi che includevano la qualità di vita tra gli endpoint, ma le cui pubblicazioni primarie non contenevano i risultati di qualità di vita, la probabilità di pubblicazione secondaria di tali risultati è stata del 12.5% a 1 anno, del 30.9% a 2 anni e del 40.3% a 3 anni dalla pubblicazione primaria. I dati di questa revisione hanno evidenziato che, nonostante da anni la qualità di vita venga riconosciuta come endpoint rilevante per la valutazione dei trattamenti oncologici, la prevalenza del suo impiego nelle sperimentazioni cliniche, nonché la completezza della presentazione dei risultati nelle pubblicazioni sono ancora largamente subottimali. Se è vero che non stupisce l’elevata percentuale di assenza di qualità di vita tra gli endpoint degli studi condotti nel setting adiuvante e neoadiuvante (dove l’obiettivo guaritivo del trattamento può in alcuni casi far esplicitamente accettare un impatto negativo – e si spera transitorio – sulla qualità di vita), lo stesso non si può dire per gli studi condotti nel setting di pazienti con malattia avanzata e metastatica, dove la valutazione complessiva del rapporto tra benefici e rischi del trattamento non dovrebbe prescindere dall’adozione dei PROs. Spiace, tra l’altro, che l’impiego della qualità di vita e la presentazione dei risultati lascino molto a desiderare anche nelle sperimentazioni accademiche, o comunque condotte da un promotore no profit. È auspicabile, peraltro, alla luce della crescente consapevolezza dell’importanza dei PROs per la definizione del valore delle terapie, che un’analisi simile condotta nei prossimi anni possa documentare una maggiore attenzione all’adozione e alla pubblicazione dei dati di qualità di vita nelle sperimentazioni cliniche condotte in ambito oncologico [3]. Passando dall’ambito delle sperimentazioni cliniche alla pratica clinica, va sottolineato che una raccolta sistematica di PROs, ad esempio mediante questionari cartacei dedicati o mediante strumenti elettronici come i tablets, oltre a rendere più fedele il report della tossicità, può servire anche a migliorare la gestione delle tossicità, potenzialmente traducendosi in un beneficio diretto per i pazienti e per la loro qualità di vita. In particolare, l’impatto positivo sulla qualità di vita è stato descritto e confermato da vari lavori, tra cui spiccano alcuni studi coordinati da Ethan Basch [5]. Il ricercatore statunitense, da anni attento all’impiego dei patient-reported outcomes e ai loro possibili benefici sia nell’ambito della sperimentazione clinica che della pratica clinica, è uno dei massimi esperti mondiali di questo argomento e negli ultimi anni ha ideato e condotto il progetto del National Cancer Institute sullo sviluppo del PRO-CTCAE, vale a dire l’incorporazione dei patient-reported outcomes nella descrizione delle tossicità dei trattamenti antitumorali. Basch ha coordinato un importante studio randomizzato, nel quale i pazienti, sottoposti a chemioterapia per vari tipi di neoplasia presso il Memorial Sloan Kettering Cancer Center, ricevevano la normale assistenza oppure (in caso di assegnazione al braccio sperimentale) potevano riportare in tempo reale, mediante uno strumento elettronico, gli eventuali sintomi [5]. Nel dettaglio, lo studio utilizzava il sistema STAR (Symptom Tracking and Reporting), un sistema web-based dedicato proprio al report dei sintomi e degli eventi avversi da parte dei pazienti. I pazienti assegnati al braccio sperimentale e che avessero dimestichezza con il computer, riportavano sistematicamente da casa, mediante tablet appositamente consegnati, 12 sintomi eventualmente occorsi durante il trattamento. I pazienti assegnati al braccio sperimentale, che invece non avessero dimestichezza con la tecnologia, riportavano i sintomi sull’interfaccia in ospedale, al momento della visita. I pazienti che disponevano di un computer a casa ricevevano, con cadenza settimanale, una mail che sollecitava il report della tossicità. I medici ricevevano, al momento della visita, una stampa di tutti i sintomi riportati dai pazienti, e gli infermieri ricevevano un avviso via email nel momento in cui i pazienti riportassero una tossicità severa, o comunque in peggioramento. Al contrario, i pazienti assegnati al braccio di controllo erano gestiti invece in maniera “tradizionale”, vale a dire con il normale colloquio con il medico e la conseguente gestione dei sintomi. Endpoint primario dello studio era la modifica nel punteggio di qualità di vita a 6 mesi dalla randomizzazione, misurata mediante l’EuroQol EQ-5D Index. Gli interessanti risultati dello studio hanno evidenziato che la percentuale di soggetti con un miglioramento della qualità di vita a 6 mesi è risultata più elevata nel braccio sperimentale rispetto al braccio di controllo (34% rispetto al 18%), e analogamente la percentuale di soggetti con un peggioramento della qualità di vita a 6 mesi è risultata minore nel braccio sperimentale (38% vs. 53% rispettivamente, p<0.001). Inoltre, nei pazienti assegnati al braccio sperimentale è stato registrato un minor numero di accessi al pronto soccorso (34% vs 41%, p=0.02), e un minor numero di ospedalizzazioni, anche se quest’ultima differenza non è risultata statisticamente significativa (45% vs 49%, p=0.08). Nel 2017, inoltre, sono stati presentati in sessione plenaria al meeting ASCO i risultati di sopravvivenza globale, che hanno documentato un’aspettativa di vita significativamente più lunga per i pazienti assegnati al braccio sperimentale [6]. Il ricorso ai patient-reported outcomes consentirebbe quindi non solo un miglioramento della qualità di vita, ma anche un prolungamento della sopravvivenza, che gli autori spiegavano ipotizzando una migliore compliance ai trattamenti antitumorali grazie alla tempestiva gestione degli eventuali effetti collaterali. Ovviamente, non tutti i pazienti inseriti nello studio erano “esperti” di tecnologia: la modalità di raccolta dei dati nell’ambito del braccio sperimentale differiva, a seconda che i pazienti avessero o meno dimestichezza con i mezzi elettronici. Peraltro, è importante notare che i dati di Basch suggerivano che il beneficio fosse evidente anche nei pazienti “digiuni” di tecnologia, per i quali la raccolta sistematica delle informazioni relative alla tossicità avveniva in ospedale, e non a casa. Indipendentemente dal vantaggio in sopravvivenza, che non era obiettivo primario dello studio, il risultato del suddetto studio in termini di qualità di vita conferma inequivocabilmente l’importanza dei PROs nella pratica clinica oncologica [7]. Anche in Italia, molti centri oncologici hanno iniziato a incorporare i PROs nella pratica clinica quotidiana, con vari livelli di informatizzazione, basandosi sull’impiego di “tradizionali” strumenti cartacei o più sofisticati e moderni strumenti elettronici. Ad esempio, a partire dal gennaio 2018 si è adottato, presso il Day Hospital di Oncologia Medica dell’AO Ordine Mauriziano di Torino, un questionario che il paziente compila descrivendo i sintomi e le tossicità riportate nel periodo trascorso dalla precedente somministrazione di terapia [8]. Il questionario viene distribuito da infermieri o medici, compilato dal paziente e riconsegnato al momento della visita successiva. È costituito da 13 domande, ognuna riferita a un sintomo / tossicità (problemi alla bocca, nausea, vomito, stipsi, diarrea, dispnea, cambiamenti nella pelle / nelle unghie, prurito, problemi a mani o piedi, fatigue, dolore, altri disturbi). Per ogni domanda è prevista una scala di 5 risposte, corrispondenti alla severità crescente. In caso di dolore, è prevista anche la compilazione di una scala numerica da 0 a 10, per descriverne l’intensità. Un’ultima domanda chiede l’eventuale persistenza dei sintomi al momento della compilazione. Gli obiettivi dell’impiego del questionario sono quelli di facilitare la comunicazione durante la visita medica, fornire uno strumento che faciliti la rilevazione e comunicazione dei sintomi e delle tossicità della terapia, permettendo un monitoraggio degli stessi, rafforzare l’alleanza terapeutica e favorire l’empowerment del paziente. Nell’ambito di un progetto supportato dalla Fondazione CRT, l’introduzione del questionario nella pratica clinica quotidiana del Day Hospital ha consentito il confronto con un gruppo di pazienti trattati, nel medesimo Day Hospital, nel periodo immediatamente precedente, vale a dire negli ultimi mesi del 2017. In entrambi i gruppi, i pazienti hanno ricevuto, a distanza di circa 1 mese l’uno dall’altro, 2 questionari EORTC QLQ-C30, che misurano la qualità di vita dei pazienti oncologici. Rispetto al gruppo trattato nel 2017, che veniva sottoposto alla visita “tradizionale”, basata solo sul colloquio con il medico al momento della visita, il gruppo di pazienti trattato nel 2018, che ha avuto l’opportunità di impiegare il questionario dedicato ai sintomi, ha riportato un beneficio significativo in termini di qualità di vita globale, misurata mediante i questionari EORTC. In particolare, vari sintomi – tra i quali il dolore – sono risultati meglio gestiti. I pazienti hanno riportato un elevato grado di soddisfazione, giudicando il questionario facilmente comprensibile e utile per migliorare la comunicazione con gli operatori sanitari. Forti di tali risultati, medici ed infermieri dell’Oncologia Medica del Mauriziano hanno adottato stabilmente il questionario per tutti i pazienti in trattamento attivo. Oggi, in particolare in quei setting caratterizzati da frequenza e complessità dei sintomi, oltre che dall’impiego di trattamenti antitumorali associati ad eventi avversi “soggettivi”, l’adozione dei patient-reported outcomes non è più considerabile sperimentale, ma va considerata parte integrante degli strumenti utili alla pratica clinica oncologica quotidiana.PROFFIT – il nuovo strumento per misurare la tossicità finanziaria
Sono passati tre anni da quando nel capitolo 3 del 9° rapporto sulla condizione assistenziale dei malati oncologici, raccontavamo del fenomeno della tossicità finanziaria. Ne parlavamo in buona misura come una storia d’oltreoceano, piuttosto lontana [9]. E raccontavamo di come i ricercatori americani avessero sviluppato uno strumento, il COST, a partire dalla esperienza di chi si ammala di cancro negli Stati Uniti, per misurare la tossicità finanziaria[10]. Ma eravamo stati sollecitati a drizzare le antenne, e prestare attenzione al fenomeno anche in Italia, dai dati che avevamo pubblicato nel 2016 [11]. Non ce lo aspettavamo, eppure avevamo trovato che in una casistica di 3760 pazienti che avevano partecipato alle sperimentazioni cliniche multicentriche nazionali promosse dall’istituto dei Tumori di Napoli, il 26% soffriva già di un problema di natura economica causato dalla malattia e dalla sua cura nel momento in cui era stato registrato nella sperimentazione. Non ce lo aspettavamo, eppure avevamo trovato che questi pazienti, nei mesi successivi, avevano un 35% di aumento del rischio di non avere alcun beneficio sulla qualità della vita, uno degli obiettivi per cui somministriamo i farmaci. Non ce lo aspettavamo, eppure avevamo trovato che il 22.5% dei pazienti peggiorava il suo disagio economico mentre lo trattavamo con la chemioterapia, nonostante non pagasse nulla una volta dentro alle mura degli Ospedali: la tossicità finanziaria. E non ce lo aspettavamo, e ci lasciò di stucco, che quest’ultimo gruppo di pazienti, quelli che sviluppavano la tossicità finanziaria, aveva un 20% di aumento del rischio di morte nei mesi e negli anni successivi.
Non ce lo aspettavamo e volevamo reagire. Ma il primo punto da affrontare, ce ne rendevamo conto, era quello degli strumenti. I dati che avevamo pubblicato derivavano da una analisi delle risposte date dai pazienti alla domanda n.28 del questionario generico per la valutazione della qualità di vita dell’EORTC (EORTC-C30). Una sola domanda, generica, utile per capire che il problema esiste, ma non utile per capirlo e per cercare di contrastarlo. E allora decidemmo, nel dicembre 2016, di iniziare il percorso di produzione di uno strumento specifico italiano applicando la metodologia internazionalmente riconosciuta come la più valida per la produzione di strumenti adatti alla autovalutazione da parte dei pazienti.
Si tratta di un percorso complesso, scrivevamo nel 2017. Di un percorso impegnativo che abbiamo affrontato grazie al supporto economico di AIRC, e con l’impegno di uno Steering Committee (riportato in appendice) cui hanno contribuito le società scientifiche oncologiche italiane (AIOM, CIPOMO), i gruppi cooperativi oncologici (FICOG) ed onco-ematologici (GIMEMA), oltre che, ovviamente, le associazioni di pazienti AIMaC e F.A.V.O.. E oggi possiamo dire di essere fieri e possiamo raccontare la strada percorsa per produrre PROFFIT, lo strumento con il quale ci auguriamo di misurare la tossicità finanziaria dei pazienti oncologici Italiani e di comprenderne i determinanti per provare a modificarli.
Il percorso
La figura seguente riassume le tappe principali del percorso, dettato dalle regole internazionali della Society for Pharmaco-economics and Outcome Research (ISPOR) Patient Reported Outcomes Content Validity Good Research Practices Task Force[12], [13].
Nel Task 1 del progetto è stato prima di tutto definito un pool iniziale di 156 concetti, mettendo insieme i risultati della revisione della letteratura, dei focus group con 34 tra pazienti e caregiver (coordinati da Silvia Riva), e delle risposte date ad uno specifico questionario da 96 oncologi AIOM e CIPOMO. Fin dall’inizio del percorso, si è deciso di garantire una distribuzione geografica che fosse rappresentativa dell’intero Paese, e per questo motivo, le prime fasi dello studio sono state condotte in tre città (Napoli, Roma, e Torino) rappresentative di tre diverse macroregioni.
I 156 concetti sono stati suddivisi in 10 librerie tematiche: burocrazia, accesso alle cure mediche, economia domestica, emotività, famiglia, lavoro, operatori sanitari, stato sociale, tempo libero, trasporti. Lo Steering Committee ha quindi rimosso 101 concetti ripetitivi e sovrapponibili, e generato la lista di 55 items che ha iniziato il suo percorso di valutazione con i pazienti.
Il task 2 del progetto è iniziato con la cosiddetta importance analysis in cui 44 pazienti hanno messo in ordine di rilevanza i singoli items all’interno di ogni libreria tematica assegnando ad ognuno di essi un punteggio da 1 (per niente importante) a 4 (molto importante). Questo ha consentito di identificare i 4 temi cui i pazienti hanno assegnato la massima rilevanza (nell’ordine: operatori sanitari, lavoro, trasporti ed emotività) e ha consentito di rimuovere dalla lista 25 items giudicati dai pazienti meno importanti (score inferiore alla mediana). Il passo successivo è stato realizzato somministrando la lista di 30 domande a ulteriori 45 pazienti (diversi dai precedenti, ma in ogni caso arruolati nelle tre città di Napoli, Roma e Torino) e conducendo con questi un cognitive debriefing che ha esplorato i problemi eventualmente esistenti relativamente alla comprensione dell’item, al recupero della memoria (quanto è facile attingere alla propria memoria per rispondere alla domanda), al giudizio sulla correttezza e applicabilità della terminologia usata, e alla adeguatezza della scala di risposta proposta. A valle della analisi del cognitive debriefing sono quindi state apportate modifiche di linguaggio per 9 items, dando luogo al cosiddetto questionario pre-finale.
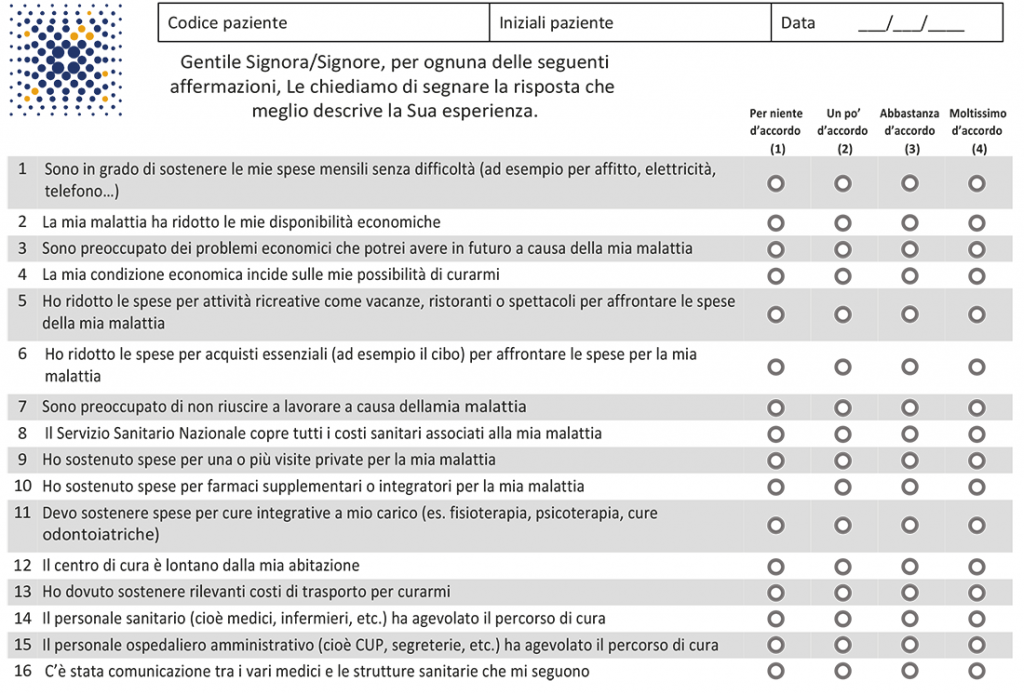
Infine, il task 3 del progetto è stato condotto allargando la partecipazione a 10 centri clinici distribuiti sull’intero territorio nazionale (riportati in appendice) che hanno arruolato 185 pazienti; in questa fase è stata, inoltre, introdotta la possibilità operativa di compilare i questionari tramite tablet, utilizzata dal 63% dei pazienti, principalmente in base alla disponibilità operativa dei centri. Il 38.9% dei pazienti è stato arruolato al Nord, l’8.1% al Centro, il 38.4% al Sud e il 14.6% nelle isole. L’età mediana era di 60 anni e il 58.9% dei pazienti era di genere femminile. La maggior parte dei pazienti è stato arruolato durante un trattamento con chemioterapia (73%). L’applicazione della analisi delle corrispondenze ha portato alla rimozione di 6 items a causa di una elevata correlazione inter-item, scegliendo di mantenere nel questionario tra due item molto correlati quello che aveva ottenuto lo score più elevato all’analisi di importanza. I rimanenti 24 items sono stati suddivisi in due gruppi: 9 items che rappresentano una misura del disagio economico e 15 items che rappresentano possibili cause (determinanti) del disagio stesso. Per il primo gruppo, l’analisi fattoriale ha portato alla identificazione di uno score composto da 7 dei 9 items che descrive e misura il disagio economico in maniera molto chiara e attendibile (alfa di Chrombach 0.70). Per il secondo gruppo, l’analisi fattoriale ha portato alla eliminazione di ulteriori 6 items, lasciandone 9 per i quali non è possibile costruire uno score cumulativo e che pertanto restano come singoli items. L’ultimo passo analitico è rappresentato dalla validazione interna dello strumento mediante analisi test-retest condotta grazie al fatto che i questionari erano stati risomministrati ai 185 pazienti a distanza di circa 3 settimane. Tale analisi ha dimostrato per i 16 items dello strumento finale ottimi coefficienti di correlazione intraclasse e elevate percentuali di concordanza. Lo Steering Committe ha infine definito l’ordine dei 16 items nel questionario finale e una procedura di assegnazione dei punteggi con semplici formule di normalizzazione per arrivare a definire un punteggio da 0 a 100 (dove a valori più alti corrisponde un significato negativo). La figura seguente riporta il questionario finale.
Il logo
Mentre lo sviluppo del questionario proseguiva secondo quanto sopra descritto, un logo grafico è stato ottenuto grazie alla collaborazione gratuita di designer coinvolti nel Corso di Progettazione per la Visualizzazione scientifica dell’Università Luigi Vanvitelli.
PROFFIT vs COST
Riprendendo l’incipit della introduzione, sono passati tre anni da quando nel capitolo 3 del 9° rapporto sulla condizione assistenziale dei malati oncologici, raccontavamo del fenomeno della tossicità finanziaria. E alla fine di quel racconto ci auguravamo che dal sentiero sul quale ci eravamo incamminati venisse fuori uno strumento concettualmente diverso dall’unico altro strumento esistente per la misura della tossicità finanziaria, il COST, prodotto negli Stati Uniti. In particolare, poiché in Italia non è ovvio che una diagnosi di cancro debba tradursi in difficoltà economiche, l’augurio era che lo strumento italiano potesse servire non solo a misurare le modalità di adattamento psicologico al problema, ma che aiutasse anche a identificarne le cause, i fattori determinanti.
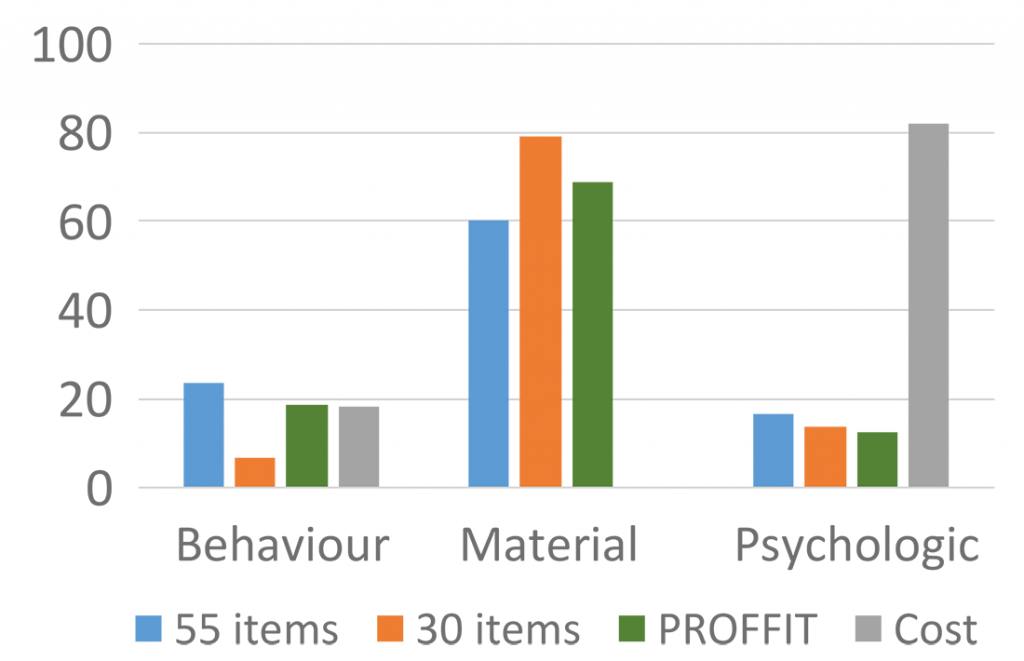
I fatti ci hanno dato ragione. La figura seguente è costruita classificando gli items del PROFFIT (nelle sue tre fasi di progressivo sviluppo a 55, 30 e 16 items) e del COST (nella sua formulazione finale di 11 items) in tre categorie secondo quanto suggerito da Altice et al.: items che esplicitano la risposta comportamentale (behaviour) al disagio economico, items che indicano le cause materiali del disagio economico e items che misurano la risposta psicologica al disagio economico [15]. Il grafico dimostra chiaramente come fina dalle prime fasi e ancor di più dopo l’intervento esclusivo dei pazienti (passaggio da 55 a 30 items) il questionario italiano sia caratterizzato da una assoluta prevalenza di items che tendono a far riflettere sulle cause del disagio, piuttosto che sulla mera risposta psicologica che al contrario prevale nettamente nel questionario originato dal vissuto dei pazienti statunitensi [16].Le prossime sfide
Il progetto di sviluppo di PROFFIT continuerà ad andare avanti nei prossimi due anni con quanto già previsto nel protocollo di studio, vale a dire la validazione esterna mediante la correlazione con strumenti validati di misura della qualità della vita e della depressione, e mediante lo studio della responsività del PROFFIT rispetto a cambiamenti della storia clinica dei pazienti che possono rappresentare chiari elementi di disagio economico (ad esempio l’impossibilità per alcuni pazienti di continuare a lavorare a causa del peggiorare della malattia). Inoltre, si inizierà a breve un ampio studio prospettico multicentrico grazie al quale si allargherà significativamente il numero di centri Italiani coinvolti.
Inoltre, poiché è chiaro che la fortuna di strumento come PROFFIT sta nel fatto di diventare di uso comune da parte di addetti ai lavori diversi da quelli che lo hanno generato, si faranno tutte le possibili azioni per promuoverne l’uso in diversi contesti.
Credits
Lo Steering Committee del PROFFIT include:
- Francesco Perrone e Jane Bryce, Unità Sperimentazioni Cliniche, Istituto Nazionale per lo Studio e la e la Cura dei Tumori, IRCCS Fondazione Pascale, Napoli (Jane Bryce attualmente lavora all’Ascension St. John Clinical Research Institute, Tulsa, USA)
- Ciro Gallo, Statistica Medica, Università degli Studi della Campania “Luigi Vanvitelli”
- Silvia Riva, St Mary’s University, Twickenham, London, UK e Fondazione IRCCS Ca’ Granda Ospedale Maggiore Policlinico, Università di Milano, Italy
- Fabio Efficace, Fondazione GIMEMA, Health Outcomes Research Unit, Roma
- Francesco De Lorenzo, Presidente AIMAC e past President European Cancer Patient Coalition
- Elisabetta Iannelli, Segretario Generale F.A.V.O.
- Laura Del Campo, Direttore F.A.V.O.
- Francesca Traclò, Responsabile area Ricerca Aimac
- Massimo Di Maio, Oncologia Medica, AO Ordine Mauriziano; Dipartimento di Oncologia, Università di Torino (rappresentante AIOM)
- Luciano Frontini, Oncologo (rappresentante FICOG)
- Vincenzo Montesarchio, Direttore Oncologia, Azienda dei Colli, Napoli (rappresentante CIPOMO)
- Diana Giannarelli, IRE – Istituto Nazionale Tumori Regina Elena, Roma
- Lara Gitto, Dipartimento di Economia Università di Messina
- Claudio Jommi, CERGAS – SDA Bocconi, Milano
- Concetta Maria Vaccaro, CENSIS (Centro Studi Investimenti Sociali), Roma
Il logo PROFFIT è stato creato dalle designers Valeria Lepore a Pierpaola Borzacchiello, durante il corso di Design per la Valorizzazione Scientifica diretto da Carla Langella, Università della Campania Luigi Vanvitelli. Nulla di questo progetto sarebbe stato possibile senza la collaborazione del personale dell’Unità Sperimentazioni Cliniche dell’Istituto Nazionale per lo Studio e la Cura dei Tumori, IRCCS Fondazione Pascale di Napoli: Maria Carmela Piccirillo, Adriano Gravina, Clorinda Schettino, Piera Gargiulo, Laura Arenare, Anna Gimigliano, Lucia Sparavigna, Giuliana Canzanella, Fiorella Romano, Valentina Barbato, Manuela Florio, Simona Bevilacqua, Gaetano Buonfanti, Alfonso Savio, Antonia Del Giudice, Teresa Ribecco, Marilena Martino, Giovanni De Matteis.
Cruciale è stato l’apporto dei ricercatori e collaboratori dei tre centri impegnati nel task 1 e 2 del progetto:
- Istituto Nazionale Tumori IRCCS – Fondazione Pascale – Napoli: Daniela Barberio, Ermelinda Quarata, Florencia Gonzalez Leone, Francesca Laudato, Maria Rosaria Esposito
- Istituto Regina Elena, Roma: Filomena Spasiano, Luana Fotia, Barbara Matrascia
- AO Ordine Mauriziano – S.C.D.U Oncologia Medica, Torino: Gaetano Lacidogna, Elisa Sperti, Francesca Vignani, Donatella Marino, Sabrina Terzolo, Luisa Fusco, Annalisa Bellezza, Laura Polimeno
I centri participanti al task 3 sono i seguenti:
- U.O.C. Oncologia Medica A.O. Garibaldi, Catania (Roberto Bordonaro)
- U.O.C. Oncologia Medica – Ospedale Senatore Antonio Perrino, Brindisi (Saverio Cinieri)
- Oncologia Medica 2 – IRCCS AOU San Martino – IST, Genova (Lucia Del Mastro)
- AO Ordine MAURIZIANO – S.C.D.U Oncologia Medica, Torino (Massimo Di Maio)
- UOS Biostatistica – Istituto Regina Elena, Roma (Diana Giannarelli)
- U.O.C. Oncologia – Presidio Monaldi – AORN dei Colli, Napoli (Vincenzo Montesarchio)
- Oncologia Medica- Ospedale Civile SS Annunziata -AOU Sassari (Antonio Pazzola)
- Istituto Nazionale Tumori IRCCS – Fondazione Pascale – Napoli (Francesco Perrone)
- Oncologia traslazionale – ICS Maugeri, Pavia (Camillo Porta)
- O. di Oncologia Medica I – Istituto Oncologico Veneto, Padova (Vittorina Zagonel)
Bibliografia
1. ^ Di Maio M, Basch E, Bryce J, Perrone F. Patient-reported outcomes in the evaluation of toxicity of anticancer treatments. Nat Rev Clin Oncol. 2016;13(5):319-25. 2. ^ Di Maio M, Gallo C, Leighl NB, Piccirillo MC, Daniele G, Nuzzo F, et al. Symptomatic toxicities experienced during anticancer treatment: agreement between patient and physician reporting in three randomized trials. J Clin Oncol. 2015;33(8):910-5. 3. ^ Fallowfield LJ. Quality of life assessment using patient-reported outcome (PRO) measures: still a Cinderella outcome? Ann Oncol. 2018;29(12):2286-7. 4. ^ Marandino L, La Salvia A, Sonetto C, De Luca E, Pignataro D, Zichi C, et al. Deficiencies in health-related quality-of-life assessment and reporting: a systematic review of oncology randomized phase III trials published between 2012 and 2016. Ann Oncol. 2018;29(12):2288-95. 5. ^ Basch E, Deal AM, Kris MG, Scher HI, Hudis CA, Sabbatini P, et al. Symptom Monitoring With Patient-Reported Outcomes During Routine Cancer Treatment: A Randomized Controlled Trial. J Clin Oncol. 2016;34(6):557-65. 6. ^ Basch E, Deal AM, Dueck AC, Scher HI, Kris MG, Hudis C, et al. Overall Survival Results of a Trial As-sessing Patient-Reported Outcomes for Symptom Monitoring During Routine Cancer Treatment. Jama. 2017;318(2):197-8. 7. ^ Sperti E, Di Maio M. Outcomes research: Integrating PROs into the clinic – overall survival benefit or not, it’s worth the trouble. Nat Rev Clin Oncol. 2017;14(9):529-30. 8. ^ Baratelli C, Turco CGC, Lacidogna G, Sperti E, Vignani F, Marino D, et al. The role of patient-reported outcomes in outpatients receiving active anti-cancer treatment: impact on patients’ quality of life. Support Care Cancer. 2019;27(12):4697-704. 9. ^ Khera N. Reporting and grading financial toxicity. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2014;32(29):3337-8. 10. ^ de Souza JA, Yap BJ, Wroblewski K, Blinder V, Araujo FS, Hlubocky FJ, et al. Measuring financial toxicity as a clinically relevant patient-reported outcome: The validation of the COmprehensive Score for financial Toxicity. Cancer. 2016. 11. ^ Perrone F, Jommi C, Di Maio M, Gimigliano A, Gridelli C, Pignata S, et al. The association of financial difficulties with clinical outcomes in cancer patients: secondary analysis of 16 academic prospective clinical trials conducted in Italy. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2016;27(12):2224-9. 12. ^ Patrick DL, Burke LB, Gwaltney CJ, Leidy NK, Martin ML, Molsen E, et al. Content validity–establishing and reporting the evidence in newly developed patient-reported outcomes (PRO) instruments for medical product evaluation: ISPOR PRO Good Research Practices Task Force report: part 2–assessing respondent understanding. Value in health : the journal of the International Society for Pharmacoeconomics and Outcomes Research. 2011;14(8):978-88. 13. ^ Patrick DL, Burke LB, Gwaltney CJ, Leidy NK, Martin ML, Molsen E, et al. Content validity–establishing and reporting the evidence in newly developed patient-reported outcomes (PRO) instruments for medical product evaluation: ISPOR PRO good research practices task force report: part 1–eliciting concepts for a new PRO instrument. Value in health: the journal of the International Society for Pharmacoeconomics and Outcomes Research. 2011;14(8):967-77. 14. ^ Riva S, Bryce J, De Lorenzo F, Del Campo L, Di Maio M, Efficace F, et al. Development and validation of a patient-reported outcome tool to assess cancer-related financial toxicity in Italy: a protocol. BMJ Open. 2019;9(9):e031485. 15. ^ Altice CK, Banegas MP, Tucker-Seeley RD, Yabroff KR. Financial Hardships Experienced by Cancer Survivors: A Systematic Review. J Natl Cancer Inst. 2016. 16. ^ Perrone F, Di Maio M, Efficace F, Gallo C, Giannarelli D, Montesarchio V, et al. Assessing Financial Toxicity in Patients With Cancer: Moving Away From a One-Size-Fits-All Approach. J Oncol Pract. 2019:JOP1900200.Scarica questo capitolo in PDF:
12° Rapporto - Capitolo 11
La centralità del paziente ed evoluzione dei Patient-Reported Outcomes (PROs) nella sperimentazione e nella pratica clinica. PROFFIT – il nuovo strumento per misurare la tossicità finanziaria