16. Mutazione genetica BRCA: medicina di precisione, PDTA ad alto rischio ed esenzione dal ticket per la sorveglianza attiva delle persone sane con mutazione genetica. Linee guida INPS sulla valutazione medico legale della disabilità delle persone con mutazione genetica BRCA
a cura di E. Iannelli e P. Varese – F.A.V.O.; A. Russo – AOU Policlinico “P. Giaccone” di Palermo; O. Campanella, A. Ferrari, R. Nonnis e S. Testa – aBRCAdaBRA; P. Musumeci – Toscana Donna; O. De Lucia e M. Piccioni – INPS
I progressi della medicina di precisione per la cura delle donne BRCA
Circa il 10% dei carcinomi della mammella e dell’ovaio rientrano nel contesto dei tumori definiti ereditari e sono determinati, nella maggior parte dei casi, dalla presenza di varianti di sequenza patogenetiche (VP) nei geni BRCA1 e BRCA2.
I geni BRCA1 e BRCA2, localizzati rispettivamente nei cromosomi 13 e 17, sono geni coinvolti nel riparo del DNA, le cui VP vengono trasmesse con modalità autosomica dominante. Tali VP non sono una causa diretta dell’insorgenza delle mammella e dell’ovaio, ma ne aumentano significativamente il rischio: è necessario infatti che coesistano altre cause affinché si sviluppi un tumore.
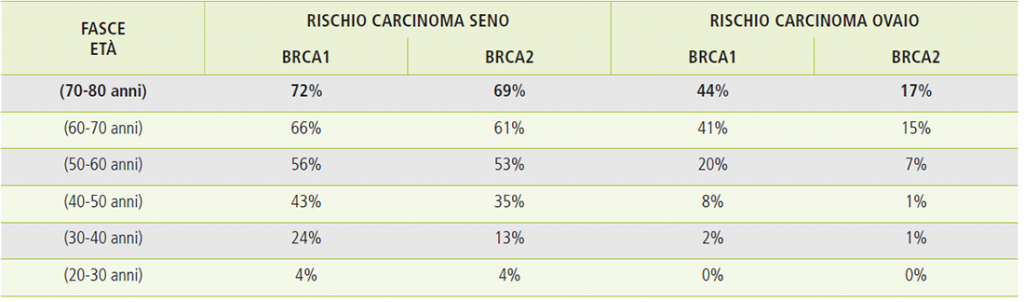
Secondo quanto riportato dalle linee guida AIOM 2018 il rischio cumulativo di carcinoma della mammella ad 80 anni è del 72% in donne con VP in BRCA1 e del 69% in donne con VP in BRCA2; il rischio cumulativo di carcinoma dell’ovaio ad 80 anni è invece del 44% in donne con VP in BRCA1 e del 17% in donne con VP in BRCA2.
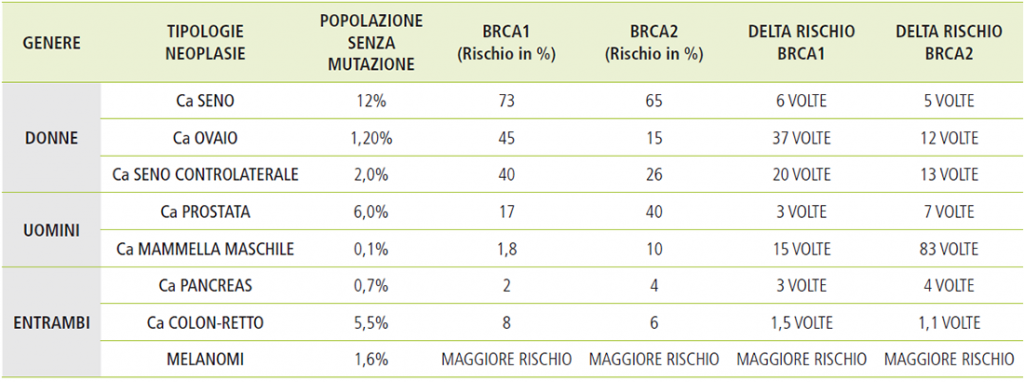
Le varianti di sequenza patogenetiche nei geni BRCA aumentano inoltre il rischio di carcinomi della mammella maschile, carcinomi della prostata, del pancreas e del colon.
L’identificazione delle Varianti di sequenza patogenetiche BRCA1/2 si coniuga perfettamente con il concetto di medicina di precisione, in quanto permette che il riscontro di tali VP, oltre ad offrire importanti informazioni prognostiche per le pazienti, diventi predittivo di una migliore risposta a specifiche terapie antitumorali. Ciò si traduce in un beneficio clinico maggiore e per un tempo più lungo per le pazienti BRCA-mutate.
Il momento cruciale per l’identificazione delle suddette varianti è quello in cui viene effettuato sulla paziente il Test Genetico; ovvero l’analisi genetica, allo scopo di identificare l’eventuale presenza di una VP. Il test genetico si inserisce all’interno del percorso di counseling oncogenetico (CGO), un atto medico multidisciplinare e multistep, essenziale sia per i soggetti affetti da neoplasia sia per i familiari sani. Nel dettaglio consente di identificare la sindrome genetica all’interno di una famiglia, di valutare il profilo di rischio, e di proporre pertanto programmi di sorveglianza personalizzati ed eventuali strategie di riduzione del rischio neoplastico. L’analisi molecolare dei geni BRCA deve essere effettuata sempre in laboratori certificati che hanno superato specifici controlli di qualità. Le tecniche più utilizzate sono il sequenziamento diretto del DNA mediante metodo di Sanger o, più recentemente, la Next Generation Sequencig (NGS) che consente di effettuare il sequenziamento di più ampie porzioni geniche con tempi ridotti e con una migliore sensibilità analitica.
Nelle pazienti che hanno già una diagnosi di carcinoma ovarico è preferibile eseguire l’analisi genetica in prima istanza sul tessuto tumorale (test definito “somatico”); qualora venga identificata nel tessuto tumorale una VP, il passo successivo è quello di ricercare la stessa VP sul sangue della paziente. Tale procedura permette di distinguere le varianti acquisite (cioè presenti solo nelle cellule tumorali, evidenziate con il test somatico) da quelle definite costituzionali o ereditarie. In quest’ultimo caso sarà importante estendere il test ai familiari di primo grado, per verificare la presenza o meno della stessa VP.
In tutti gli altri casi il test genetico viene eseguito direttamente su campione ematico.
Il significato clinico delle eventuali varianti di sequenza individuate dev’essere interpretato consultando specifici database informatizzati riconosciuti dalla comunità scientifica. Per la refertazione può essere utilizzato uno schema a tre o a cinque categorie. Nello specifico il test genetico può essere:
- positivo: viene identificata una variante di sequenza patogenetica;
- non conclusivo: viene identificata una variante di sequenza di significato clinico sconosciuto (VUS);
- negativo: non viene riscontata una variante di significato clinico patogenetico.
Come accennato prima, il significato clinico del test genetico è oggi triplice: ha un ruolo prognostico, perché le pazienti con VP BRCA hanno un migliore outcome clinico, preventivo, perché consente di individuare programmi di sorveglianza e strategie di riduzione del rischio e, recentemente, è stato evidenziato anche un importante ruolo predittivo.
Studi retrospettivi hanno infatti evidenziato che le pazienti affette da carcinoma ovarico, portatrici di una variante patogenetica BRCA, hanno una maggiore sensibilità farmacologica a diversi farmaci, tra cui le combinazioni terapeutiche contenenti derivati del platino. Inoltre le VP nei geni BRCA rappresentano un biomarcatore predittivo di maggiore sensibilità al trattamento con inibitori dell’enzima Poli (ADP-ribosio) Polimerasi (PARP), che interviene nella riparazione del DNA danneggiato a singolo filamento, nelle pazienti affette da carcinoma dell’ovaio in fase avanzata. L’efficacia dei PARP inibitori come opzione terapeutica nel carcinoma dell’ovaio si realizza attraverso un meccanismo di “letalità sintetica” in presenza di una concomitante perdita di funzione dei meccanismi di riparazione del DNA a doppio filamento mediante ricombinazione omologa (HR), nei quali le proteine BRCA1/2 svolgono un ruolo essenziale.
Recenti Studi Clinici mostrano inoltre come i Parp-inibitori possano determinare un beneficio clinico anche nelle pazienti affette da carcinoma della mammella e quindi in futuro il test genetico potrebbe avere, anche in queste pazienti, un significato predittivo.
Per quanto riguarda il significato predittivo del test, qualora questo fosse positivo (cioè presenza di una VP), la ricerca della stessa VP va estesa a tutti i membri della famiglia partendo dai familiari di primo grado. A tutti i soggetti in cui viene riscontrata una VP va consegnato lo specifico programma di riduzione del rischio oncologico, che sarà quindi fondamentale sia per i soggetti sani sia per la prevenzione di secondi tumori in pazienti che hanno già una diagnosi di tumore.
Il programma di riduzione del rischio è stilato in relazione al sesso, all’età e all’anamnesi personale e familiare e comprende strategie di riduzione del rischio clinico-strumentali e chirurgiche che andranno ampiamente discusse con la paziente all’interno del percorso di counseling oncogenetico.
I PDTA Alto Rischio Eredo-Familiare e l’Esenzione dal Ticket. Lo stato dell’arte nella approvazione e attuazione in Italia
Rischi di tumori associati alle mutazioni BRCA1-BRCA2 e dati epidemiologici
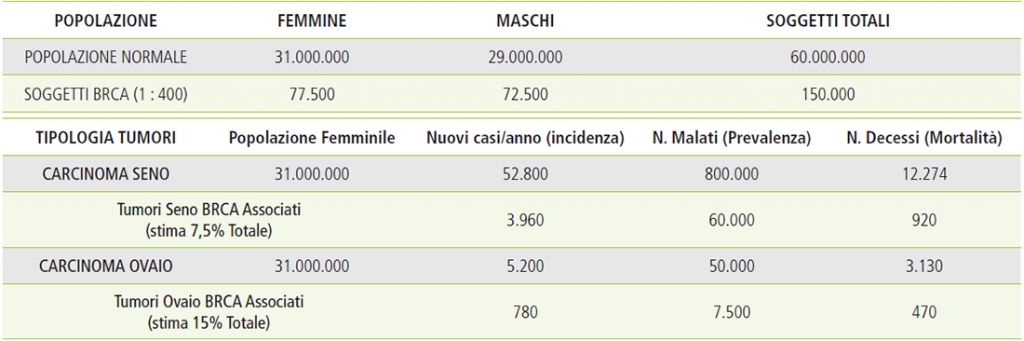
La maggior parte dei tumori della mammella e dell’ovaio sono sporadici e quindi contraddistinti da mutazioni che si sviluppano all’interno dei due organi nel corso della vita. Tra di essi un numero ristretto ma comunque significativo è correlato ad una predisposizione ereditaria, riconducibile in particolare alle mutazioni dei geni BRCA1 e BRCA2: si stima che si tratti del 7,5% dei tumori della mammella e del 15% dei tumori dell’ovaio. Le donne con mutazioni genetiche germinali BRCA1-BRCA2 presentano un rischio molto elevato di contrarre questi due specifici tumori (Sindrome Ereditaria di carcinoma della mammella e dell’ovaio) nel corso della loro vita, a partire dai 20 anni (Tabella 1). I rischi associati alle mutazioni BRCA coinvolgono anche altri organi e il genere maschile, ma con percentuali notevolmente inferiori a quelle della mammella e dell’ovaio (Tabella 2).
Tabella 1: rischio cumulativo del carcinoma della mammella e dell’ovaio per fasce di età[1]
Tabella 2: rischio cumulativo tumori associati a mutazioni brca1-brca2[2]
Tabella 3: soggetti brca in italia ed epidemiologia dei tumori brca associati[5]
Quadro normativo e contenuti dei PDTA Alto Rischio Eredo-Familiare (PDTA AREF)
I Protocolli di Diagnosi, Trattamento e Assistenza per Persone ad Alto Rischio Eredo-Familiare (PDTA AREF), a seguito di una prima esperienza pionieristica nella Regione Emilia Romagna (2012), sono stati inseriti ufficialmente per la prima volta nella legislazione nazionale all’interno del Piano Nazionale Prevenzione PNP 2014- 2018[8], che ha definito specifici obiettivi e tempistiche di attuazione dei PDTA AREF in tutte le Regioni Italiane e nelle due Province Autonome (Trento e Bolzano).In particolare, il legislatore ha indicato le seguenti linee-guida per le persone portatrici di mutazioni BRCA:
- per i soggetti affetti da carcinoma mammario e/o ovarico devono essere effettuati specifici interventi chirurgici (in caso di tumore alla mammella la mastectomia oncologica per il seno affetto e la mastectomia profilattica per il seno controlaterale sano; in caso di tumore dell’ovaio la annessiectomia oncologica), volti a prevenire sia eventuali recidive sia l’insorgenza di nuovi tumori, altamente probabile in soggetti ad elevato rischio genetico;
- sui soggetti malati devono essere utilizzati, al momento ancora a livello sperimentale, nuovi trattamenti farmacologici (es. PARP inibitori) specificatamente studiati per tale tipologia di soggetti (mutazioni germinali) e/o di tumori (mutazioni somatiche);
- per i soggetti sani dovrebbe essere prevista l’estensione graduale dei programmi di screening (a partire dai familiari di persone malate), volti ad intercettare il maggior numero di persone ad elevato rischio di malattia;
- ai soggetti sani devono essere offerte le due opzioni preventive della sorveglianza intensificata (esami e visite annuali e semestrali agli organi a rischio) e della chirurgia profilattica (mastectomia profilattica e annessiectomia profilattica). Questa seconda opzione oggi si sta dimostrando la più efficace per la riduzione efficace dei rischi di malattia, a causa dei limiti tuttora esistenti nella diagnosi precoce sia per il carcinoma dell’ovaio sia in alcune tipologie specifiche di carcinoma della mammella (es. triplo negativo) – molto diffuse nei soggetti con mutazione BRCA – con età di insorgenza relativamente giovane (sotto i 40 anni e talvolta 30 anni), estremamente aggressive e ad evoluzione rapida, anche nell’intervallo tra due controlli ravvicinati.I PDTA Alto Rischio, dal punto di vista gestionale e organizzativo, si configurano come uno dei protocolli clinici delle Reti Oncologiche Regionali, delle Reti Regionali di Senologia e delle singole Breast Unit, queste ultime per loro caratteristiche “centri interdisciplinari di presa in carico” di soggetti sani e malati, come sancito dalla Conferenza Stato Regioni al momento della loro approvazione[9].Inoltre, proprio per una più efficace ed efficiente “presa in carico” dei soggetti sani – data l’elevata incidenza della compartecipazione ai costi dei programmi di sorveglianza intensificata – i PDTA AREF regionali dovrebbero essere integrati e completati dalla esenzione dal ticket anche per tutti i soggetti sani con mutazione BRCA accertata (criteri LEA – Livelli essenziali di assistenza), relativamente agli esami e alle visite periodiche previste dagli stessi protocolli.
Stato di attuazione in Italia dei PDTA Alto Rischio Eredo-Familiare
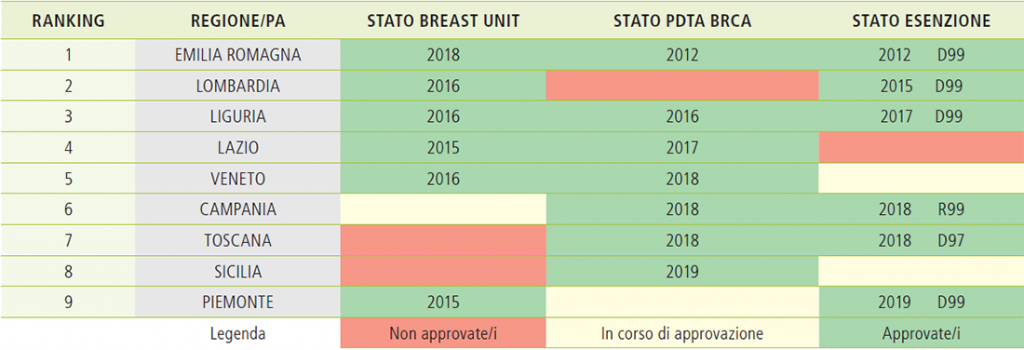
Il processo per l’introduzione dei PDTA Alto Rischio in Italia, per un eccesso di tutela del legislatore nei confronti delle prerogative regionali in ambito sanitario, è stato avviato in modo non direttivo da parte del Ministero della Salute: in primo luogo sono stati inseriti, quasi surrettiziamente, in uno degli obiettivi dei programmi di screening del PNP 2014-2018; inoltre non sono state fornite alle Regioni precise Linee Guida Nazionali, lasciando di fatto a ciascuna di esse la libertà – ma anche la necessità – di definire il proprio specifico percorso attuativo. Tale scelta ha comportato la mancanza di obiettivi specifici, una eccessiva discrezionalità, uno spreco di risorse, un allungamento dei tempi di approvazione e di attuazione, un difficoltoso coordinamento da parte del Ministero della Salute. Un altro vulnus di tale processo è stato il mancato coinvolgimento delle Associazioni di Pazienti, lasciandolo interamente nelle mani degli operatori del settore (medici, società scientifiche, strutture ospedaliere, funzionari e politici regionali), non sempre dotati di una approfondita e aggiornata conoscenza delle problematiche specifiche delle persone ad elevato rischio genetico, anche per la complessità della materia, altamente interdisciplinare e soggetta ad una velocissima e continua evoluzione. Nonostante questi limiti nel corso dell’ultimo anno lo stato di approvazione e di attuazione dei PDTA in Italia ha visto una forte accelerazione (Tabella 4: Stato di approvazione dei PDTA Alto Rischio in Italia).
Tabella 4: stato di approvazione dei pdta alto rischio in italia[10]
Rispetto ai tre anni precedenti 2015-2016-2017, in cui solo due regioni (Liguria e Lazio) si erano affiancate all’Emilia Romagna nella approvazione dei PDTA AREF e solo due (Lombardia e Liguria) nella esenzione del ticket, nel corso del 2018 e nei primi tre mesi del 2019 altre quattro regioni hanno approvato il PDTA AREF (Veneto, Campania, Toscana e Sicilia) e due di esse anche la esenzione del ticket (Campania-R99 e Toscana- D97). Inoltre il Piemonte ha di recente deliberato la sola esenzione del ticket, in attesa della approvazione del PDTA AREF. Nel frattempo anche le altre regioni rimaste hanno avviato o stanno avviando i Gruppi di Lavoro dei PDTA per mettersi in condizione di adempiere alla normativa entro la scadenza del PNP 2014-2018, prorogata al 31.12.2019.
Criticità e prospettive future dei PDTA Alto Rischio Eredo-Familiare
Purtroppo, non sempre alla approvazione legislativa regionale corrisponde una immediata e piena attuazione dei PDTA all’interno delle Breast Unit e delle Aziende Ospedaliere, dove si realizza la effettiva presa in carico delle persone. Le numerose testimonianze raccolte dall’Associazione ABRCADABRA, oltre a confermare una situazione nazionale “a macchia di leopardo”, evidenziano ancora molteplici criticità: la difficoltà di accesso e i lunghi tempi di attesa per i test genetici per i familiari sani, la scarsa informazione sulle opzioni chirurgiche oncologiche e profilattiche sia per le persone malate sia e soprattutto per quelle sane, le carenze nel supporto psicologico ai pazienti con mutazione accertata, la carenza di protocolli di sorveglianza per i maschi (mammella, prostata, pancreas, colon-retto, melanomi), la difficoltà di accesso ai nuovi farmaci a bersaglio molecolare (PARP inibitori), che spesso costituiscono una preziosa e ultima opportunità per malattie in stadio avanzato e con scarse alternative terapeutiche (carcinomi all’ovaio e alla mammella metastatici e triplo negativo). Inoltre, i continui progressi della medicina (nuovi farmaci, nuovi test multi-genici, nuovi test genomici sui tumori, nuove tecniche chirurgiche più conservative) impongono una continua revisione degli stessi PDTA AREF già approvati, per poter adeguare la “presa in carico dei pazienti” allo stato dell’arte scientifico e clinico del momento. Per i soggetti sani, invece, la sfida maggiore è quella dello screening esteso e auspicabilmente completo di tutta la popolazione con una mutazione BRCA che, oltre a ridurre l’incidenza delle malattie e la mortalità, consentirebbe nel medio e lungo termine un risparmio notevole dei costi elevati e crescenti – dovuti agli interventi chirurgici e alle terapie farmacologiche[11] -, oltreché evitare i non quantificabili costi sociali diretti e indiretti che gravano sulle persone e sulle famiglie.Per l’insieme di tali motivazioni e per la necessaria accelerazione del complesso processo in atto nelle Regioni, ci sono le condizioni per l’elaborazione di Linee-Guida BRCA Nazionali – attraverso la collaborazione tra Ministero della Salute, Regioni, Società Scientifiche e il coinvolgimento delle Associazioni di Pazienti – che possano recepire le migliori esperienze in corso, al fine di avviare un processo permanente di verifica, confronto e miglioramento dei PDTA AREF in tutte le Breast Unit italiane.
Comunicazione tecnico-scientifica INPS “Mutazione dei geni BRCA e rischio oncologico. Il carcinoma mammario BRCA-mutato. Il carcinoma ovarico BRCA-mutato. Aspetti clinici e valutazione medico legale in ambito assistenziale”
Nei paragrafi precedenti e nel Rapporto 2018[12] sono stati descritti il rischio di sviluppo di un cancro della mammella e dell’ovaio in donne portatrici della mutazione BRCA e le tabelle hanno evidenziato il numero totale delle nuove diagnosi/anno nonché la prevalenza di tutte le donne con neoplasia accertata.
In questo paragrafo esamineremo l’impatto bio-psico-sociale di una malattia legata a una mutazione genetica.
Approcci clinici alle donne con mutazioni BRCA:
Sono possibili tre diversi approcci clinici che vanno dalla sorveglianza intensiva, alla farmacoprevenzione fino alla chirurgia profilattica.
Secondo un modello probabilistico citato dalla Linee Guida AIOM, senza alcun intervento (cioè non screening e non mastectomia profilattica) la probabilità di sopravvivenza a 70 anni è pari al 53% per le donne BRCA-1 mutate, mentre è pari al 71% per le BRCA-2 mutate, rispetto all’84% della sopravvivenza della popolazione generale femminile USA, mentre la combinazione di mastectomia profilattica a 25 anni e di ovariectomia profilattica a 40 anni aumenta la sopravvivenza globale a 70 anni d’età per le donne BRCA-1 mutate fino al 79% e per le BRCA-2 mutate fino all’83%, simile a quella della popolazione femminile generale (84%).
Ma cosa significa questo per la singola persona con mutazione BRCA?
È evidente che ogni scelta di trattamento preventivo ha implicazioni psico-fisiche e socio-relazionali di grande impatto soprattutto nei casi, non certo rari, di donne giovani che magari hanno desiderio di avere dei figli. O di madri che figli li hanno già e si sentono in “colpa” al solo pensiero di poter aver trasmesso loro il gene mutato. Di seguito riportiamo una sintesi, riadattate alle finalità di questo capitolo, tratta dalle Linee Guida AIOM 2018 che ad oggi costituiscono il documento più aggiornato e diffuso nel mondo oncologico.
Chirurgia profilattica
È stato calcolato che la mastectomia bilaterale profilattica, cioè l’asportazione delle ghiandole mammarie, sia in grado di ridurre in modo significativo il rischio di sviluppare una neoplasia mammaria fino al 95%.
Le diverse tecniche chirurgiche non sembrano presentare una grande variabilità in termini di riduzione del rischio anche se tecniche più conservative comportano un minimo aumento del rischio per la possibilità di esistenza di maggiore tessuto mammario residuo specie in sede retroareolare.
La salpingoovariectomia bilaterale comporta mediamente una riduzione del rischio del carcinoma ovarico dell’80% e una riduzione del rischio del 50% di sviluppare un carcinoma mammario.
Non è indicata come prassi routinaria l’asportazione dell’utero sebbene anche questo tipo di neoplasia possa insorgere nelle donne con mutazione BRCA.
La mastectomia, sia essa curativa che profilattica, è una tecnica demolitiva che consiste nell’asportazione completa del tessuto ghiandolare mammario, della cute e del complesso areola-capezzolo. Alcune tecniche di mastectomia, definite di tipo conservativo, preservano la cute e il complesso areola-capezzolo e sono quelle maggiormente utilizzate nelle mastectomie preventive o quando la neoplasia non coinvolge il complesso areola-capezzolo e dista almeno un cm dalla cute.
Le sequele chirurgiche dopo una mastectomia sono diverse. Vanno dalla perdita di sensibilità della cute e del capezzolo alle limitazioni funzionali degli arti superiori, queste ultime legate anche alle tecniche di ricostruzione adottate dopo l’asportazione della ghiandola mammaria. Nelle ricostruzioni con tessuti eterologhi, che prevedono l’utilizzo di espansori e/o di protesi esterne posizionati sotto il muscolo grande pettorale, le sequele possono essere di tipo algico e di limitazione funzionale dei movimenti che nei casi peggiori possono compromettere l’attività lavorativa e la qualità della vita. Le tecniche con tessuto autologo, mediante l’utilizzo di tessuto muscolo-cutaneo proveniente dalla stessa paziente DIEP, se si preleva dall’addome, o del muscolo gran dorsale, quando si preleva dal dorso, aumentano il numero delle cicatrici con sequele fisiche e funzionali che possono interessare anche i distretti corporei da cui è stato asportato il tessuto.
Le mastectomie, sia curative che profilattiche, sono dunque entrambe gravate di una certa morbilità che varia da caso a caso e che talvolta si somma ad alterazioni muscolo scheletriche preesistenti aggravandole.
Anche la perdita di sensibilità della cute e del complesso areola-capezzolo, con privazione di solito permanente della funzione erettile, può risultare menomante in quanto altera la percezione del corpo e compromette lo stimolo erogeno con ripercussioni psicologiche e sulla sfera sessuale della donna. L’immagine corporea sarà differente e comporterà un adattamento psico-fisico che sarà indipendente dalla qualità del risultato cosmetico.
Nelle mastectomie curative se la paziente ha avuto l’asportazione dei linfonodi dell’ascella potrebbe verificarsi una perdita o riduzione della sensibilità a livello del braccio e/o della parete toracica con un intorpidimento o sensazione di freddo, debolezza del braccio, maggiore sensibilità al tocco o alla pressione, sensazione di bruciore o prurito, formicolio, dolori alle ossa.
Il Linfedema dell’arto superiore è una sequela chirurgica che si può verificare quando si è effettuata l’asportazione dei linfonodi ed è caratterizzata da un gonfiore del braccio con impotenza funzionale. È un fenomeno che può presentarsi settimane o anche mesi dopo l’operazione o addirittura dopo anni e richiede un counselling adeguato, una supporto educazionale attento e progetti riabilitativi personalizzati.
Sorveglianza strumentale
Le procedure consolidate per le donne BRCA 1-2 mutate sono:
- Ecografia mammaria semestrale dal momento della detection
- Mammografia annuale dai 35 anni fino ai 69 anni, poi
- Risonanza magnetica (MRI) mammaria annuale a partire dall’età di 25
- Ecografia transvaginale e CA-125 ogni 6 mesi a partire dall’età di 30
Farmacoprevenzione
È confermato il ruolo del tamoxifene (20 mg/die per 5 anni) nei confronti di neoplasie ormonodipendenti ma i dati nelle donne con mutazione BRCA non sono conclusivi.
È dimostrato, come peraltro nel resto della popolazione, un effetto protettivo, in caso di positività per i recettori ormonali, del tamoxifene sul rischio di sviluppo del cancro mammario controlaterale in pazienti già diagnosticate per una neoplasia.
In Italia, comunque, con la determina del 29.11.2017, AIFA ha inserito il tamoxifene nell’elenco dei medicinali erogabili a totale carico del Servizio Sanitario Nazionale (legge 648), per il trattamento preventivo del carcinoma mammario in donne ad alto rischio e il raloxifene per le donne in postmenopausa ad alto rischio.
Ad oggi l’indicazione all’uso degli inibitori dell’aromatasi per la chemioprevenzione del cancro della mammella non è registrata in alcun Paese.
La farmacoprevenzione, come d’altro canto la salpingoovariectomia, comporta una sindrome menopausale precoce con sintomi da deprivazione estrogenica, impatto sugli aspetti cognitivi, la sessualità, il metabolismo osseo, che devono essere attentamente valutati e discussi con la singola paziente.
Il problema del counselling genetico e le ricadute psicologiche
La stima del rischio genetico può implicare importanti cambiamenti nel modo in cui l’individuo percepisce sé stesso e la sua famiglia e può avere ripercussioni sul senso di identità personale e sul senso di appartenenza familiare determinando un grado di indeterminatezza che influisce sulla capacità di tollerare l’ansia.
Le reazioni psicologiche all’esito del test genetico sono correlate a più fattori tra i quali il contenuto della comunicazione ricevuta, il tipo di personalità e la percezione che la donna ha del proprio rischio di ammalarsi, la sua storia, i suoi obiettivi di vita.
La malattia correlata con una mutazione genica contiene al suo interno un “vulnus” psicologico cruciale: la sensazione della “perdita di controllo” sulla propria vita che, scardinando l’impianto di vita della donna, può portare allo sviluppo di vere sindromi psichiatriche. La presenza di uno psicologo nella fase di comunicazione della identificazione di una mutazione genetica, è, pertanto, fondamentale anche perché quest’ultima può avere ripercussioni su tutta la famiglia.
Le criticità percepite dalle pazienti portatrici di mutazioni BRCA1-BRCA2 nell’accertamento della condizione di disabilità.
Da un’indagine conoscitiva condotta dalla Associazione aBRCAdaBRA Onlus nel corso del 2018, è emerso che gran parte delle iscritte (donne con mutazione BRCA) all’esito dell’accertamento presso le Commissioni mediche per l’invalidità civile e l’handicap matura il convincimento che:
- i membri delle Commissioni non avrebbero una “adeguata conoscenza” medica sulla tematica BRCA, in particolare sugli elevati “rischi di tumore connessi alla mutazione”, sui protocolli diagnostici e di trattamento previsti dai PDTA Alto rischio Eredo-Familiare e sulle problematiche connesse ai follow-up di malattia né sulla assoluta necessità degli interventi chirurgici profilattici di riduzione del rischio, sia nelle donne già malate ad uno degli organi coinvolti (mammella e ovaio) sia in quelle sane;
- la progressiva riduzione della percentuale di invalidità e del grado di handicap riconosciuti alle donne malate nel corso delle successive revisioni dimostrerebbe la tendenza a considerare la paziente “guarita o libera da malattia”, trascurando il dato scientificamente assodato che una donna con una mutazione BRCA è costantemente e per tutta la sua vita ad elevato rischio di malattia – recidiva, nuovi tumori, progressione metastatica – e va tenuta strettamente sotto controllo, anche dopo gli interventi chirurgici;
- le complicanze e le conseguenze che comunque gli interventi profilatici comportano (menomazione di organi riproduttivi in età fertile, menopausa anticipata, osteoporosi, linfedema, cardiopatie, problemi psicologici e nella sfera affettiva e sessuale) sarebbero sottostimate.
Sulla base di tale quadro ricognitivo, ancorché fondato sulla esclusiva percezione soggettiva delle donne intervistate, aBRCAdaBRA e F.A.V.O. nel dicembre 2018 hanno formulato una richiesta congiunta al Coordinamento Generale Medico Legale dell’INPS per l’elaborazione di una “Comunicazione tecnico-scientifica INPS” volta a garantire le migliori condizioni per una valutazione equa ed omogenea da parte delle Commissioni mediche che operano sul territorio nazionale per le donne con mutazione BRCA, sia sane che malate. Tale istanza ha riscontrato immediata disponibiltà e specifica competenza da parte del Coordinamento Generale Medico Legale, tant’è che nel giro di poche settimane il Coordinamento Generale Medico Legale dell’INPS ha redatto e reso pubblica il 13 febbraio 2019, nella sua rete interna, la Comunicazione tecnico-scientifica “Mutazione dei geni BRCA e rischio oncologico. Il carcinoma mammario BRCA-mutato. Il carcinoma ovarico BRCA-mutato. Aspetti clinici e valutazione medico legale in ambito assistenziale” che offre precise e puntuali risposte sia alle donne malate sia alle donne sane (finora del tutto prive di una tutela specifica).
I contenuti innovativi medico-legali della Comunicazione INPS
Le indicazioni INPS per la valutazione medico legale delle donne BRCA mutate possono così essere riassunte:
Donne sane con mutazione BRCA: valutazione dell’invalidità civile
— opzione totale per la profilassi chirurgica
Le Commissioni mediche i sono chiamate a valutare, sulla base dei codici tabellari, le seguenti menomazioni:
mastectomia bilaterale (od. 8006: fisso 34%)
La tabella non opera alcun distinguo in relazione al tipo di intervento (mastectomia totale, Skin Sparring, Nipple Sparring, con o senza ricostruzione) e deve ritenersi applicabile a qualsiasi tipo di mastectomia unilaterale che abbia conseguito l’esito chirurgico atteso. Il maggior danno, all’immagine corporea e all’identità femminile, correlato alla bilateralità va valutato, con criterio analogico quantitativo, nella misura del 40%.
salpingo-ovariectomia bilaterale in età fertile (cod. 6604: salpingectomia bilaterale in età fertile: fisso 35%) L’interpretazione letterale presupporrebbe che il Legislatore abbia inteso tutelare la sola asportazione delle tube e non il più frequente intervento di ovaro-salpingectomia bilaterale. In tal caso non si spiegherebbe come una condizione di sola impotenza generandi possa risultare valutata in modo superiore (35%) rispetto all’esito della “isterectomia totale in età fertile” (25%: cod. 6604), che invece comporta la più grave condizione di impotenza generandi e gestandi. Su tali presupposti, avendo a mente i più autorevoli baremes per la valutazione del danno biologico, si deve ritenere che il codice 6604 sia in realtà riferito agli esiti, che qui ci riguardano, dell’annessiectomia bilaterale in età fertile (impotenza generandi e menopausa precoce).
In caso di istererectomia (per il rischio, pur se basso, di carcinomi uterini ad alta aggressività) associata ad annessiectomia bilaterale profilattica (impotenza gestandi, impotenza generandi e menopausa precoce) la valutazione globale, secondo i principi della concorrenza, può essere proposta nella misura del 40%.
L’integrazione della valutazione della mastectomia bilaterale e della ovarosalpingectomia bilaterale (o istero- annessiectomia bilaterale) va operata con riferimento alle previsioni della coesistenza, insistendo su organi- funzione diversi, derivandone una valutazione pari al 61% (64% quando sia associata l’isterectomia). patologie psichiatriche che si sviluppano a seguito della chirurgia mutilante
La donna BRCA mutata è chiamata ad affrontare intensi fattori stressogeni sin dal momento in cui ha notizia dell’esito del test genetico (improvviso impatto con una realtà inattesa di grave pericolo per la salute e la vita; percezione come “colpa” della possibile trasmissione ai figli; necessità di scegliere la profilassi) e soprattutto all’esito della chirurgia (compromissione dell’immagine di sé, dell’identità femminile, della vita sessuale, riproduttiva e relazionale, menopausa precoce). La menomazione psichica andrà presa in considerazione e integrata con formula scalare agli esiti della chirurgia, allorché travalichi i limiti della comune reattività all’evento avverso e assuma pertanto autonoma valutabilità medico legale e potrà trovare giusto apprezzamento nei codici: 2204- S. depressiva endoreattiva lieve: 10%; 2205 S. depressiva endoreattiva media: 25%; S. depressiva endoreattiva grave: 31-40%.
Poiché gli esiti chirurgici vanno considerati come stabilizzati, la disposizione di una revisione può ritenersi correttamente disposta solo allorché alla valutazione concorra in modo significativo la patologia psichica reattiva.
- opzione per la sorveglia clinico-strumentale
In tal caso non sussistono, almeno fino all’eventuale sviluppo di neoplasie, menomazioni fisiche direttamente o indirettamente riconducibili alla mutazione. La valutazione medico legale a fini di invalidità dovrà quindi tener conto delle sole ripercussioni psichiche, più o meno gravi, pressoché invariabilmente correlate a tale condizione e troverà utile riferimento nella voce codificata, di volta in volta più indicata, prevista dalla vigente tabella.
Donne sane con mutazione BRCA: valutazione dell’handicap
A prescindere dall’opzione profilattica intrapresa, tutte le donne con mutazione BRCA devono considerarsi in condizione di handicap ai sensi dell’art. 3, c 1, L. 104/1992 (… difficoltà di apprendimento, di relazione o di integrazione lavorativa e tale da determinare un processo di svantaggio sociale o di emarginazione); la connotazione di gravità (… necessario un intervento assistenziale permanente, continuativo e globale nella sfera individuale o in quella di relazione) andrà valutata caso per caso allorché la patologia psichiatrica abbia assunto particolare rilevanza.
Donne con mutazione BRCA e ca mammario o ovarico: valutazione di invalidità civile e handicap
Le donne trattate per un carcinoma mammario o ovarico che risultino BRCA mutate devono affrontare anch’esse il medesimo iter, chirurgico o di sorveglianza, per la profilassi di una nuova neoplasia mammaria o ovarica. Pertanto nella valutazione medico legale, sia per invalidità che per handicap, si dovrà tener conto, oltre che degli esiti e della prognosi del tumore già trattato, con riferimento ai noti codici 9322, 9323, 9325 delle tabelle e alle Linee guida INPS 2012 per i casi non pienamente inquadrabili in una delle previsioni tabellari, anche di quanto già dettagliato nel precedente paragrafo in merito alla valutazione degli esiti fisici e/o psichici del trattamento profilattico.
Il processo valutativo descritto, pur rigorosamente fondato sull’uso dei codici e dei criteri di composizione previsti dal D.M. 5 febbraio 1992, si configura, per altri e più sostanziali versi, come fortemente innovativo. La portata innovativa della proposta va infatti individuata nello spostamento del focus valutativo dalla “patologia” (nella fattispecie mero “rischio di”) all’effettivo oggetto di tutela: la restrizione di partecipazione alla vita socio-lavorativa. Impostazione questa pienamente coerente e per certi aspetti anticipatoria, rispetto ai non ancora attuati principi che qualificano la rinnovata definizione di “disabilità” dettata dalla legge 3 marzo 2009, n. 18 (Ratifica ed esecuzione della Convenzione delle Nazioni Unite sui diritti delle persone con disabilità – N.Y, 13 dicembre 2006).
La comunicazione INPS costituisce, in sostanza, un primo significativo passo verso l’introduzione di un concreto modello valutativo bio-psico-sociale della disabilità correlata al cancro e al rischio oncologico, considerando non solo l’impatto degli aspetti psicologici e fisici legati agli interventi di chirurgia profilattica, ma anche le ricadute relazionali e sociali in termini di effetto sulla potenzialità riproduttiva e sull’identità femminile delle donne e rappresenta un modello di approccio socio-assistenziale al tema delle neoplasie ereditarie del tutto nuovo e pienamente in sintonia con le strategie della sorveglianza clinica “individualizzata”.
L’INPS, ancora una volta, ha dimostrato di sapere “leggere” i tempi e di saper ascoltare le Associazioni dei pazienti perseguendo un sistema di tutela sempre più adeguato alla scienza, ai bisogni nuovi delle persone e all’evoluzione normativa nazionale e sovranazionale.
Note
1. ^ K. Kuchenbaecker et al., Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers, JAMA 2017. 2. ^ Fonti: L. Ottini et al, Prediction of Breast and Prostate Cancer Risks in Male BRCA1 and BRCA2 Mutation Carriers, Journal of Clinical Oncology, 27.04.2017; K.B. Kuchenbaecker et al, Risks of Breast, Ovarian and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers, JAMA, 20.06.2017; N. Petrucelli et al, BRCA1 and BRCA2 Associated Hereditary Breast and Ovarian Cancer, GeneReviews, 15.12.2016. 3. ^ AC Antoniou et al, A comprehensive model for familial breast cancer incorporating BRCA1, BRCA2 and other genes, Br. J. Cancer, 2002. 4. ^ I numeri del cancro, AIOM-AIRTUM, 2018. 5. ^ ISTAT (popolazione); I numeri del cancro, AIO-AIRTUM, 2018 (Tumori); AS Whittemore et al, Prevalence of BRCA1 mutation carriers among US non-Hispanic Whites, Cancer Epidemiol. Biomarkers Prev., 2004 (incidenza tumori BRCA associati), aBRCAdaBRA Onlus (stime popolazione BRCA e tumori BRCA associati). 6. ^ Nice, Familial breast cancer: classification, care and managing breast cancer and related risks in people with a family history of breast cancer, 2013 (update 2017). 7. ^ AIOM, Linee guida Neoplasie della mammella, 2018; AIOM, Raccomandazioni per l’implementazione del test BRCA nelle pazienti con carcinoma ovarico e nei familiari a rischio elevato di neoplasia, 2018. 8. ^ Piano Nazionale della Prevenzione 2014-2018, Conferenza Stato-Regioni, 13.11.2014. 9. ^ Linee di indirizzo sulle modalità organizzative ed assistenziali della rete dei Centri di Senologia, Conferenza Stato-Regioni, 18.12.2014. 10. ^ Fonte: Osservatorio PDTA Alto Rischio Eredo-Familiare, Europa Donna Italia e aBRCAdaBRA Onlus, marzo 2019. 11. ^ A. Cicchetti et al, Cost-Effectiveness of A Preventive Testing Strategy in Relatives of Patients with BRCA Mutated Ovarian Cancer Versus A No Test Strategy, Altems, 2016. 12. ^ X Rapporto dell’Osservatorio sulla condizione assistenziale dei malati oncologici (F.A.V.O. et alii), maggio 2018.Scarica questo capitolo in PDF:
11° Rapporto - Capitolo 16
Mutazione genetica BRCA: medicina diprecisione, PDTA ad alto rischio ed esenzione dal ticket per la sorveglianza attiva delle persone sane con mutazione genetica. Linee guida INPS sulla valutazione medico legale della disabilità delle persone con mutazione genetica BRCA